Пегилированный интерферон альфа-2а
- 1 year ago
- 0
- 0

| Интерферон гамма | |
|---|---|
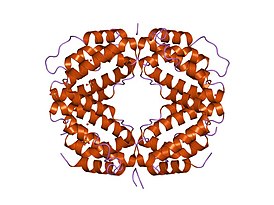
Кристаллическая структура биологически активной одноцепочечной мутации интерферона человека |
|
| Идентификаторы | |
| Символ | IFN gamma |
| Pfam | |
| Pfam clan | |
| Доступные структуры белков | |
| Pfam | |
| PDB | ; ; |
Интерферон гамма ( IFNγ ) – это димеризованный растворимый цитокин , который является единственным членом класса интерферонов II типа . Э. Ф. Уилок обнаружил этот интерферон, который в начале своей истории был известен как иммунный интерферон. Он описал его как продукт человеческих лейкоцитов, стимулированных фитогемагглютинином. Впоследствии его назвали продуктом антиген-стимулированных лимфоцитов . Также было выявлено, что он продуцируется в лимфоцитах человека , туберкулин-сенсибилизированных перитонеальных лимфоцитах мыши , заражённых PPD ; результаты показали, что полученные супернатанты ингибируют рост вируса везикулярного стоматита. Эти отчёты также содержали основные наблюдения, лежащие в основе широко применяемого в настоящее время анализа высвобождения гамма-интерферона, используемого для тестирования на туберкулёз. У людей белок IFNγ закодирован в гене IFNG .
IFNγ, интерферон II типа, это цитокин, который имеет решающее значение для врождённого и приобретённого иммунитета против вирусных, некоторых бактериальных и протозойных инфекций. IFNγ является важным активатором макрофагов и индуктором экспрессии молекул главного комплекса гистосовместимости II класса (MHC). Аберрантная экспрессия IFNγ ассоциирована с рядом аутовоспалительных и аутоиммунных заболеваний. Важность IFNγ в иммунной системе частично обусловлена его способностью непосредственно ингибировать репликацию вируса и, самое главное, его иммуностимулирующим и иммуномодулирующим действием. IFNγ продуцируется преимущественно естественными киллерами ( NK ) и естественными Т-киллерами ( NKT ) как часть врождённого иммунного ответа, а также эффекторными Т-клетками CD4 Th1 и CD8 цитотоксических Т-лимфоцитов ( CTL ) после развития антигенспецифического иммунитета как часть адаптивного иммунного ответа. IFNγ также продуцируется нецитотоксическими врождёнными лимфоидными клетками (ILC), семейством иммунных клеток, впервые обнаруженных в начале 2010-х годов.
IFNγ мономер состоит из ядра из шести α-спиралей и расширенной развёрнутой последовательности в С-концевой области. Это показано в структурных моделях ниже. α-спирали в ядре структуры пронумерованы от 1 до 6.

Биологически активный димер образуется путём антипараллельного взаимоблокирования двух мономеров, как показано ниже. В нарисованной модели один мономер показан красным цветом, другой – синим.

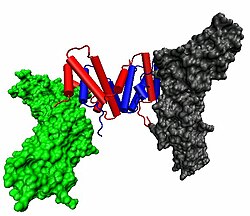
Клеточные реакции на IFNγ активируются путём его взаимодействия с гетеродимерным рецептором, состоящим из (ИФНГР1) и ((ИФНГР2). Связывание IFNγ с рецептором активирует . IFNγ также связывается с гликозаминогликаном (HS) на поверхности клетки. Однако в отличие от многих других гепарансульфатствязывающих белков, где связывание способствует биологической активности, связывание IFNγ с HS ингибирует его биологическую активность.
Структурные модели, показанные на рис. 1-3 для IFNγ , все укорочены на своих С-концах 17-тью аминокислотами. Полная длина IFNγ составляет 143 аминокислоты в длину, модели - 126 аминокислот в длину. Аффиность к гепарансульфату находится исключительно в пределах удалённой последовательности из 17 аминокислот. . В этой последовательности из 17 аминокислот лежат два кластера основных аминокислот, называемых D1 и D2 соответственно. Гепарансульфат взаимодействует с обоими этими кластерами. В отсутствие гепарансульфата присутствие последовательности D1 увеличивает скорость образования комплексов IFNγ-рецепторов. Связываясь с D1, HS может конкурировать с рецептором и препятствовать образованию активных рецепторных комплексов.
Биологическое значение взаимодействия гепарансульфатов с IFNγ неясно, однако связывание кластера D1 с HS может защитить его от протеолитического расщепления .
IFNγ секретируется T-хелперами (в частности, T h 1-клетками), цитотоксическими Т-лимфоцитами (T C -клетки), макрофагами, эпителиоцитами слизистой оболочки и естественными киллерами . IFNγ является единственным II Типом интерферона , и серологически отличается от интерферонов I Типа; он является кислотно-лабильным, в то время как I Тип, кислотно-стабильный.
IFNγ обладает противовирусными, иммунорегулирующими и противоопухолевыми свойствами. Он изменяет транскрипцию до 30 генов, вызывая различные физиологические и клеточные реакции.
К числу таких свойств относятся:
Естественные клетки и цитотоксические Т-лимфоциты также продуцируют IFNγ. IFNγ подавляет образование остеокластов , быстро деградируя RANK адапторного белка TRAF6 в сигнальном пути RANK - RANKL , который в противном случае стимулирует выработку NF-κB .
Гранулёма – это ответная реакция организма на вещество, которое он не может удалить или стерилизовать. Инфекционные причины гранулём (инфекции обычно являются наиболее распространённой причиной гранулём) включают: туберкулёз , лепра , гистоплазмоз , криптококкоз , , бластомикоз и токсоплазмоз. Примерами неинфекционных гранулёматозных заболеваний являются саркоидоз , болезнь Крона , бериллиоз , гигантоклеточный артериит , , гранулёматоз Вегенера , лёгочные и аспирация пищи и других твёрдых частиц в лёгкие. Инфекционная патофизиология гранулём обсуждается здесь в первую очередь.
Ключевая связь между IFNγ и гранулёмами заключается в том, что IFNγ активирует макрофаги, так что они становятся более мощными в уничтожении внутриклеточных организмов. Активация макрофагов IFN γ из h 1 –хелперов при микобактериальных инфекциях позволяет макрофагам преодолеть ингибирование созревания , вызванное микобактериями (оставаться живыми внутри макрофагов). Первыми шагами в формировании IFNγ -индуцированной гранулёмы являются активация T h 1-хелперов макрофагами, высвобождающими IL-1 и в присутствии внутриклеточных патогенов, и презентация антигенов этих патогенов. Затем T h 1-хелперы объединяются вокруг макрофагов и высвобождают IFNγ, который активирует макрофаги. Впоследствии активация макрофагов вызывает цикл дальнейшего уничтожения внутриклеточных бактерий и дальнейшей презентации антигенов T h 1-хелперам с дальнейшим высвобождением IFNγ. Наконец, макрофаги окружают T h 1-хелперы и становятся фибробластоподобными клетками, ограждающими инфекцию.
( NK ) выделяют высокие уровни хемотаксисов , таких как IFNγ. IFNγ расширяет и истончает стенки спиральных артерий матери, чтобы усилить приток крови к месту имплантации. Это ремоделирование помогает развитию плаценты, поскольку она вторгается в матку в поисках питательных веществ. Мыши с нокаутом IFNγ не могут инициировать во время беременности нормальную модификацию артерий. Эти модели показывают аномально низкое количество клеток или некроз .
Рекомбинантный человеческий интерферон гамма, как дорогостоящий биофармацевтический препарат, проявляется в различных системах экспрессии, включая прокариотические, простейшие, грибковые (дрожжи), растительные, насекомые и клетки млекопитающих. Человеческий интерферон гамма обычно экспрессируется в кишечную палочку , продаваемую как ACTIMMUNE®, однако полученный продукт прокариотической экспрессионной системы не гликозилируется с коротким периодом полураспада в кровотоке после инъекции; процесс очистки от бактериальной экспрессионной системы также очень дорогостоящий. Другие системы экспрессии, такие как , не показали удовлетворительных результатов с точки зрения урожайности.
Интерферон гамма ещё пока не одобрен для лечения ни в одной иммунотерапии рака . Однако улучшение выживаемости наблюдалось при введении интерферона гамма пациентам с раком мочевого пузыря и меланомой . Наиболее многообещающий результат был достигнут у пациенток со 2-й и 3-й стадиями рака яичников . Напротив, подчёркивалось: «Интерферон-γ, секретируемый CD8-позитивными лимфоцитами, усиливает регуляцию PD-L1 на раковых клетках яичников и способствует росту опухоли» Исследование in vitro ИФН-гамма в раковых клетках довольно обширны, и результаты указывают на антипролиферативную активность ИФН-гаммы, приводящую к ингибированию роста или гибели клеток, обычно индуцируемой апоптозом, но иногда и аутофагией . Кроме того, известно, что у млекопитающих происходит гликозилирование человеческого интерферона гамма, экспрессируемого в HEK 293 , что повышает его терапевтическую эффективность по сравнению с негликозилированной формой, которая экспрессируется в кишечной палочке .
Было выяснено, что интерферон-γ взаимодействует с .
Интерферон-γ играет решающую роль в иммунном ответе против некоторых внутриклеточных патогенов, включая болезнь Шагаса . Он также играет определённую роль в себорейном дерматите.
Анти- моноклональное антитело было одобрено для лечения .
Существуют доказательства того, что экспрессия интерферона гамма регулируется псевдозависимым элементом в его 5' UTR, а также прямо или косвенно микроРНК : miR-29. Экспрессия этого интерферона регулируется через GAPDH в Т-клетках.. Это взаимодействие происходит в 3'UTR, где связывание GAPDH препятствует трансляции последовательности мРНК.
{{
cite journal
}}
: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (
ссылка
)