Корепрессор
- 1 year ago
- 0
- 0

Лакто́зный репре́ссор ( англ. Lac repressor ) — , который ингибирует экспрессию генов , кодирующих белки лактозного оперона . Кодируется геном lacI . Белки лактозного оперона участвуют в метаболизме лактозы в клетках бактерий . Эти гены подавляются, когда лактоза недоступна клеткам, гарантируя, что бактериальная клетка не будет тратить энергию на синтез белков, метаболизирующих лактозу, в условиях её отсутствия. Когда лактоза становится доступной, она преобразуется в , которая ингибирует способность лактозного репрессора связываться с ДНК. Когда репрессор не связан с оператором лактозного оперона, начинаются его транскрипция и последующий синтез ферментов метаболизма лактозы .
Структура лактозного репрессора
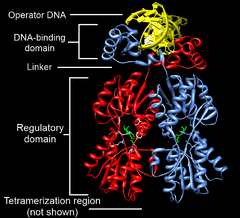
Лактозный репрессор ( lac -репрессор) кишечной палочки Escherichia coli представляет собой гомотетрамер массой 154 520 дальтон . Каждый из четырёх мономеров содержит 360 аминокислотных остатков и состоит из N-концевого домена , шарнирного, или линкерного, участка, домена, связывающего сахар , и С-концевого домена. N-концевой домен содержит «спираль-поворот-спираль» , который отвечает за взаимодействие с оператором. Этот мотив образуют две α-спирали (аминокислотные остатки 6—25). N-концевой домен представляет собой небольшой, компактный глобулярный домен с хорошо выраженным , который создают три α-спирали. Линкерный, или шарнирный, участок (остатки 46—62) соединяют ДНК -связывающий N-концевой домен с сахар-связывающей частью (кором) репрессора. Считается, что этот участок не имеет выраженной вторичной структуры и состоит из разрозненных спиралей, однако в присутствии ДНК он упорядочивается и образует α-спираль, которая взаимодействует с оператором и определённым образом ориентирует ДНК-связывающий домен lac -репрессора. Кор репрессора, или сахар-связывающий домен, состоит из двух субдоменов. Пространственная структура субдоменов очень похожа, хотя между ними прослеживается мало сходства в составе аминокислотных остатков. Каждый субдомен содержит 6 параллельных , зажатых между четырьмя α-спиралями. С-концевой домен отвечает за сборку тетрамера .
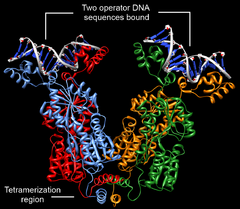
Лактозный репрессор — необычный тетрамер. Его мономеры формируют стабильные димеры . Это взаимодействие обеспечивается пятью кластерами аминокислот. Димеры, в свою очередь, могут объединяться с образованием тетрамеров за счёт взаимодействия С-концевых альфа-спиралей (остатки 340—357). Каждая спираль содержит два участка, состоящих из семи остатков лейцина , которые и обеспечивают взаимодействие четырёх альфа-спиралей. Тетрамеры лактозного репрессора корректнее рассматривать как димеры димеров, поскольку они не имеют симметрии, характерной для других олигомерных белков. Связывание с ДНК осуществляют именно димеры, то есть каждый тетрамер лактозного репрессора может быть связанным с двумя операторами .
Как упоминалось выше, связывание лактозного репрессора с ДНК происходит через N-концевой структурный мотив спираль-поворот-спираль, который связывается с большой бороздкой ДНК . Кроме того, с ДНК связываются шарнирные области. Связывание происходит за счёт взаимодействия упорядоченных спиралей шарнирных областей и малой бороздки ДНК . Так как каждый тетрамер может связывать одновременно два оператора, связывание нескольких последовательностей операторов одним тетрамером вызывает выпетливание ДНК . Связывание репрессора с ДНК увеличивает сродство РНК-полимеразы к промотору настолько, что она не может покинуть его, поэтому не может начаться элонгация транскрипции генов лактозного оперона. В присутствии лактозы аллолактоза связывается с lac -репрессором, аллостерически изменяя его пространственную структуру так, что репрессор оказывается неспособным к прочному связыванию с оператором. В исследованиях, проводимых in vitro , в качестве вещества, имитирующего действие аллолактозы, часто используют изопропил-β-D-1-тиогалактопиранозид (ИПТГ) .
Лактозный репрессор был впервые Уолтером Гилбертом и ( англ. Walter Gilbert and Benno Müller-Hill ) в 1966 году. Это случилось через год после того, как Жак Моно и Франсуа Жакоб , описавшие лактозный оперон, получили Нобелевскую премию по физиологии и медицине за свои исследования в области регуляции экспрессии генов. Гилберт и Мюллер-Хилл смогли показать в условиях in vitro , что белок связывается с ДНК, содержащей лактозный оперон, и отделяется от ДНК при добавлении ИПТГ. Они также выделили часть ДНК, связанную с белком, с помощью фермента дезоксирибонуклеазы , который расщепляет ДНК. После обработки комплекса репрессор-ДНК этим ферментом некоторые молекулы ДНК оставались нерасщеплёнными; было выдвинуто предположение, что они были защищены репрессором от действия фермента, что было позже подтверждено. Эти эксперименты подтвердили механизм работы лактозного оперона, ранее предложенный Моно и Жакобом .