Interested Article - Хлорметин
- 2020-12-10
- 1
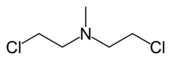
Хлорметин ( лат. Chlormethinum , англ. chlormethine , BAN chlormethine ) — исторически первый цитостатический препарат алкилирующего типа, производное бис-β-хлорэтиламина , азотистый аналог иприта .
В США хлорметин также известен как мехлоретамин ( mechlorethamine ), что, однако, не является зарегистрированным USAN именем, и мустин ( mustine ), газ HN2 , азотистый иприт HN2 ( nitrogen mustard HN2 ) или просто HN2 , а также под торговой маркой Мустарген ( Mustargen ), в странах бывшего СССР известен также как эмбихин
История открытия хлорметина
Изначально азотистые иприты , или азотистые аналоги иприта , азотистые аналоги горчичного газа были известны как группа органических веществ общей формулы R-N-(СН 2 -СН 2 -Сl) 2 , где R = либо СН 3 -, либо С 2 Н 5 -, либо -СН 2 -СН 2 -Сl. Интерес к этим веществам изначально был обусловлен возможностью их военного применения в качестве потенциального химического оружия. По общеядовитому и сильному кожно-нарывному действию эти соединения аналогичны "обычному" иприту (сернистому иприту). Однако впоследствии некоторые из азотистых аналогов иприта (азотистых ипритов) нашли совершенно иное применение — в качестве противоопухолевых цитостатических препаратов.
Американские фармакологи Луис Гудман и Альфред Гилман исследовали три различных азотистых аналога иприта в качестве потенциальных лечебных агентов — так называемые «газ HN1», «газ HN2» и «газ HN3». Показавший наилучшее соотношение эффективность / токсичность «газ HN2» в итоге и стал лекарством, ныне известным как хлорметин, мехлоретамин, мустин или мустарген.
|
|
|
До начала использования алкилирующих агентов в химиотерапии злокачественных опухолей, многие из них были уже известны в качестве «горчичного газа» (
иприта
и его аналогов), использовавшихся в качестве
химического оружия
кожно-нарывного типа во время
Первой Мировой войны
. Азотистые аналоги иприта были исторически первыми алкилирующими агентами, использовавшимися в
медицине
, и первыми примерами современной химиотерапии злокачественных опухолей. Гудман, Гилман и их коллеги в
Йельском университете
начали изучать азотистые аналоги иприта в
1942 году
. И вскоре после обнаружения того факта, что введение этих агентов иногда приводит к значительному уменьшению и даже полному исчезновению экспериментальных злокачественных опухолей у
лабораторных
мышей
, эти химиотерапевтические агенты были впервые протестированы на
людях
в конце этого же года. Использование «газа HN2» — метил-бис-(β-хлорэтил)-амина гидрохлорида (позже ставшего известным как
хлорметин
, он же
мехлоретамин
, или
мустин
,
мустарген
,
эмбихин
) и «газа HN3» — трис-(β-хлорэтил)-амина гидрохлорида для химиотерапевтического лечения запущенных случаев
лимфогранулематоза
,
лимфомы
и
лимфосаркомы
,
лейкозов
и других злокачественных опухолей, особенно
гематологических
у пациентов-добровольцев часто приводило к быстрому уменьшению или даже временному полному исчезновению опухолевых масс. Однако потом с неизбежностью возникали
рецидивы
, причём уже с устойчивостью к хлорметину («газу HN2») и к «газу HN3». Ввиду высокой степени секретности, окружавшей эти разработки, как и всё, связанное с исследованиями в области
боевых отравляющих веществ
, результаты исследований Гудмана и Гилмана о противоопухолевой активности мехлоретамина и «газа HN3» не были опубликованы вплоть до
1946 года
.
Эти публикации вызвали взрыв
энтузиазма
в среде
онкологов
и резкий рост интереса к прежде не существовавшей области химиотерапевтического лечения злокачественных опухолей человека.
В последующие 25 лет после публикации Гудмана и Гилмана о противоопухолевой активности хлорметина («газа HN2») и «газа HN3» были синтезированы десятки новых алкилирующих химиопрепаратов, обладавших заметно меньшей токсичностью (в частности, меньшей гематологической токсичностью, меньшей способностью вызывать выраженную миелосупрессию) и более широким спектром противоопухолевого действия. В частности, многие из вновь синтезированных алкилирующих агентов оказались применимы не только при гемобластозах, но и при различных солидных злокачественных опухолях. К таким удачным разработкам относятся, например, мелфалан и циклофосфамид , сохранившие своё значение и широко применяемые в химиотерапии злокачественных новообразований и по сей день.
Распространённый миф утверждает, что якобы Гудману и Гилману пришло в голову (или было предложено их начальством из Йельского университета) изучить потенциальную пригодность азотистых аналогов иприта в качестве возможных средств для химиотерапии злокачественных новообразований после того, как в 1943 году случился инцидент в Италии , в городе Бари, где выжившие после воздействия «горчичного газа» солдаты и мирные жители длительное время страдали от выраженной лейкопении. Однако на самом деле эксперименты по химиотерапевтическому лечению злокачественных опухолей с помощью азотистых аналогов иприта, сначала на животных , а затем и на добровольцах-людях, начались за год до события в Бари, в 1942 году. Гилман не упоминает об эпизоде в Бари как об имевшем какое-либо значение или оказавшем какое-либо влияние на их с Гудманом научные изыскания по противоопухолевой активности азотистых аналогов иприта, хотя он, несомненно, знал об этом эпизоде. А способность иприта вызывать выраженную лейкопению, миелосупрессию и иммуносупрессию была известна задолго до опытов Гудмана и Гилмана, ещё с 1919 года , со времён окончания Первой Мировой войны .
Фармакологическое действие
Высокотоксичный и высокоактивный цитостатический препарат алкилирующего типа, с преимущественной активностью в отношении лейкозных клеток и сравнительно малой активностью в отношении клеток солидных опухолей .
Показания
Препарат бывает эффективен при остром и хроническом и , лимфо- и , лимфогранулематозе , грибовидном микозе, отчасти при мелкоклеточном раке лёгкого .
В настоящее время его применяют в основном при лечении лимфогранулематоза в системе комплексной терапии. В терапии других опухолей и гемобластозов практически не применяется, так как не имеет преимуществ перед более современными, более эффективными и менее токсичными цитостатиками. В России в качестве лекарственного средства на данный момент не зарегистрирован.
Способ применения и дозы
Вводят мехлоретамин внутривенно. При ударной методике вводят в течение 4 дней в общей дозе 0,4 мг/кг (по 0,1 мг/кг в день) или 0,4 мг/кг однократно. Иногда пользуются дробнопротяжной методикой: препарат вводят в дозе 5 — 6 мг три раза в неделю; общая доза (за 8 — 20 введений) составляет 40 — 120 мг.
Лечение прекращают при снижении содержания лейкоцитов в крови до 2,5 — 3 х 10^9/л.
Мехлоретамин можно вводить также в (0,2 мг/кг в 10 — 50 мл изотонического раствора натрия хлорида ) при наличии в них выпота , содержащего опухолевые клетки.
Лечение мехлоретамином должно проводиться под тщательным врачебным наблюдением.
При применении препарата могут возникнуть осложнения и побочные явления, связанные с его местными раздражающими свойствами и общим токсическим действием, особенно влиянием на гемопоэз .
При внутривенном введении мехлоретамина следует тщательно следить за тем, чтобы раствор не попал под кожу , так как возможно появление инфильтрата и некроза ткани. Рекомендуется капельное введение сильно разбавленных растворов мехлоретамина через венозный катетер большого диаметра, установленный в центральной вене (например, ). Струйное введение также лучше производить в центральную, а не периферические вены.
В случае попадания раствора в подкожную жировую клетчатку следует немедленно ввести в это место большое количество изотонического раствора натрия хлорида. При возникновении инфильтрата применяют компрессы .
Следует очень остерегаться попадания растворов препарата на слизистые оболочки и кожу больного и медицинского персонала. Если это произошло, необходимо немедленно тщательно смыть препарат большим количеством воды.
Перед введением мехлоретамина обязательна противорвотная премедикация одним из препаратов группы сетронов, дексаметазоном и метоклопрамидом .
В процессе лечения мехлоретамином необходимо следить за изменениями картины крови. Серьёзным осложнением при передозировке препарата может быть глубокое угнетение функции костного мозга с резким подавлением гемопоэза, вплоть до явлений аплазии кроветворной ткани (с летальным исходом).
При лечении дробными дозами мехлоретамина влияние на и тромбоцитопоэз выражено в меньшей степени.
Примечания
- Goodman L.S., Wintrobe M.M., Dameshek W., Goodman M.J., Gilman A.Z., McLennan M.T. Nitrogen mustard therapy (англ.) // JAMA . — 1946. — Vol. 132 , no. 3 . — P. 126—132 . — doi : .
- ↑ Scott R.B. Cancer chemotherapy--the first twenty-five years (англ.) // Br Med J. : journal. — 1970. — Vol. 4 , no. 5730 . — P. 259—265 . — doi : . — . — PMC .
- Gilman A. (неопр.) // Am J Surg.. — 1963. — Т. 105 , № 5 . — С. 574—578 . — doi : . — .
Ссылки
- 2020-12-10
- 1
