Interested Article - Пембролизумаб
- 2020-12-31
- 1
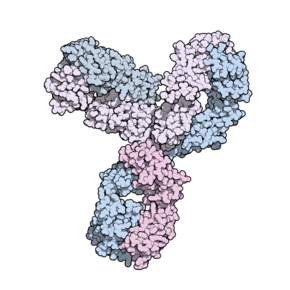
Пембролизумаб ( англ. pembrolizumab ) — фармацевтическая субстанция, иммуноонкологический препарат для лечения злокачественных опухолей , ингибитор PD-1 (поверхностного белка иммунных и опухолевых клеток), моноклональное антитело . Разработан компанией Мерк (MSD) .
Ранние названия: ламбролизумаб ( англ. lambrolizumab ), MK-3475, SCH-900475 .
В 2015 году пембролизумаб одобрен Еврокомиссией для лечения меланомы . В России препарат зарегистрирован в 2016 году с торговым названием Китруда , с 2018 года включен в перечень ЖНВЛП Минздрава РФ .
Описание
Пембролизумаб является белком, это человеческое моноклональное антитело, иммуноглобулин типа IgG4 каппа. Молекулярная масса около 149 кДа .
Препарат предназначен для лечения меланомы и немелкоклеточного рака лёгкого . Среди противоопухолевых препаратов это первый, разрешённый FDA для лечения разнообразных опухолей не по параметрам опухоли, но по наличию биомаркеров у пациентов
По рекомендации FDA пембролизумаб может применяться для лечения взрослых и детей при неоперабельных или метастатических опухолях, характеризующимися высокой микросателлитной нестабильностью (MSI-H) и нарушениями в системе репарации ДНК (dMMR) . Также он показан пациентам с прогрессирующим после и во время химиотерапии заболеванием при отсутствии других методов терапии .
Может использоваться для лечения следующих заболеваний: рак шейки матки , рак прямой кишки , рак желудка , рак головы и шеи, рак печени , немелкоклеточный и мелкоклеточный рак лёгких , рак поджелудочной железы , урогенитальный рак, рак пищевода , карцинома клеток Меркель, карцинома почечных клеток, злокачественная меланома, диффузная большая лимфома В-клеток, болезнь Ходжкина , твердые опухоли .
Среди первых ингибиторов иммунных контрольных точек пембролизумаб единственный получил одобрение FDA по результатам клинического исследования III фазы (KEYNOTE-045), другие на момент одобрения прошли КИ только I и/или II фаз
В 2019 году препарат проходит клинические испытания на людях (третья стадия фармакологических испытаний) для лечения рака мочевого пузыря, рака молочной железы, рака эндометрия, рака фаллопиевых труб, рака желудочно-кишечного тракта, мезотелиомы, множественной миеломы, рака носоглотки, рака яичников, перитонеального рака, рака простаты, плоскоклеточного рака . В частности, его применение при лечении метастатического трижды негативного рака молочной железы оказалось неэффективным . Более ранние стадии испытаний проводятся для многих других онкологических заболеваний. Начаты предварительные испытания с целью лечения инфекций папилломавируса человека . В испытаниях первой фазы , в которой проверяется безопасная дозировка препарата, пембролизумаб сразу показал клинический эффект — два пациента были полностью вылечены, и несколько получили значительное улучшение .
Пембролизумаб является безопасным и эффективным препаратом для лечения меланомы .
Препарат может снижать выживаемость пациентов при неправильном назначении, он показан только при высокой экспрессии биомаркера PD-L1 .
В 2017 году 100 мл препарата продавались по цене 245 тыс. рублей .
Фармакологические свойства
Механизм действия
Пембролизумаб селективно блокирует взаимодействие между белком PD1 и его лигандами PDL1 и PDL2 . PD1 является рецептором программируемой смерти ( апоптоза ) клетки, это рецептор контрольной точки, который ограничивает активность Т-лимфоцитов в периферических тканях, и опухолевые клетки могут использовать этот механизм для обхода противоопухолевого иммунитета. Блокируя PD1, Пембролизумаб препятствует блокированию активности Т-лимфоцитов опухолевыми клетками и таким образом восстанавливает подавленный опухолевыми клетками противоопухолевый иммунитет .
Фармакодинамика
После лечения пембролизумабом в дозировках 2 мг/кг каждые три недели или 10 мг/кг каждые две или три недели у пациентов наблюдалось увеличение процентного содержания активированных CD4+ и CD8+ T-лимфоцитов, при этом общее число T-лимфоцитов оставалось приблизительно неизменным .
Фармакокинетика
Препарат практически полностью распределяется по плазме крови, специфическое связывание с белками крови отсутствует (как и у других антител). Специфичный метаболизм отсутствует, подвергается катаболизму неспецифичными путями, что не сказывается на его клиренсе. Системный клиренс — приблизительно 0,2 л/день, пропорционально выше при большой массе тела, не зависит от возраста. Период полувыведения приблизительно 27 дней. Системное накопление выше при введении каждые 3 недели, максимальная равновесная концентрация достигается на 19 неделе. Почечная недостаточность средней и лёгкой тяжести и лёгкая печёночная недостаточность не влияют на скорость выведения препарата .
Применение
Пембролизумаб применяется при лечении меланомы и одного из видов немелкоклеточного рака лёгкого , рак прямой кишки в случае, когда стандартная химиотерапия не дала результатов . Также он применяется у пациентов с любыми видами злокачественных опухолей, у которых есть мутации в гене эпидермального фактора роста (EGFR) или в гене киназы анапластической лимфомы (ALK), в случае прогрессирования заболевания при таргетном лечении (обычно препаратами платины) .
Препарат предназначен для внутривенного введения, 30−минутные инфузии производятся один раз в 3 недели в дозировке 2 мг/кг массы тела пациента .
- Показания
- Меланома .
- Немелкоклеточный рак лёгкого, при котором наблюдается положительная экспрессия белка PDL1 .
- Трижды негативный рак молочной железы
- Противопоказания
- Тяжёлая степень почечной недостаточности.
- Тяжёлая и средняя степени печёночной недостаточности.
- Беременность и период грудного вскармливания.
- Возраст до 18 лет.
- Побочные действия
В клинических испытаниях пембролизумаба серьёзные нежелательные побочные явления наблюдались у 9% пациентов. У 4% из них лечение препаратом было прервано из-за опасности для жизни пациентов .
Нежелательные побочные эффекты в большинстве случаев можно купировать при их раннем выявлении и правильном своевременном лечении .
- Аллергия на препарат.
Лёгкие побочные действия :
- повышенная утомляемость, сыпь, диарея, снижение аппетита, лихорадка, зуд, кашель, одышка, боль в мышцах, запор и тошнота.
Гипотиреоз
и
гипертиреоз
1 и 2 степени тяжести
.
Средней тяжести и тяжёлые, в том числе опасные для жизни
:
- Инфузионные реакции;
- Иммунологические реакции: пневмонит, колит, нефрит, эндокринопатия, гепатит.
- После применении Пембролизумаба были случаи смерти при аллогенной трансплантации костного мозга .
См. также
Примечания
- ↑ . Drug Profile (англ.) . Adis Insight (30 августа 2019). Дата обращения: 30 августа 2019. 1 ноября 2017 года.
- ↑ Жулина, Ксения . Журнал «Клиническая фармация» . Издательство ОКИ (9 августа 2015). Дата обращения: 30 августа 2019. 30 августа 2019 года.
- . Новости GMP (7 июня 2017). Дата обращения: 30 августа 2019. 30 августа 2019 года.
- ↑ .
- ↑ .
- ↑ Харченко, Е. В. . ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н. Н. Петрова» Минздрава РФ (23 мая 2017). Дата обращения: 30 августа 2019. 30 августа 2019 года.
- ↑ (англ.) . Drugs.com (23 мая 2017). Дата обращения: 30 августа 2019. 30 августа 2019 года.
- Матвеев, Всеволод Борисович. : [ 23 октября 2019 ] / Всеволод Борисович Матвеев, Анна Сергеевна Маркова // Урология сегодня : журн. — 2018. — № 4 (55). — С. 6–7.
- . Журнал «Фармакогенетика и Фармакогеномика» (5 июня 2019). Дата обращения: 30 августа 2019. 30 августа 2019 года.
- Талантов, П. В. 0,05 : Доказательная медицина от магии до поисков бессмертия. — М. : АСТ : CORPUS, 2019. — С. 317. — 560 с. — (Библиотека фонда «Эволюция»). — ББК 54.1 . — УДК . — ISBN 978-5-17-114111-0 .
- ↑ , с. 22.
- Жулина, Ксения . Журнал «Клиническая фармация» . Издательство ОКИ (4 сентября 2018). Дата обращения: 30 августа 2019. 30 августа 2019 года.
- .
- .
- (англ.) . DailyMed . U. S. National Library of Medicine. [ аффилированный источник? ]
Литература
- Hamid, O. Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma : [ англ. ] / O. Hamid, C. Robert, A. Daud … [ et al. ] // New England Journal of Medicine. — 2013. — Vol. 369, no. 2 (11 July). — P. 134–134. — doi : . — PMID . — PMC .
- Самойленко, И. В. : [Систематический обзор клинических исследований и ретроспективных наблюдений.] / И. В. Самойленко, Л. В. Демидов // Медицинский совет : журн. — 2017. — № 6. — С. 8–23. — doi : .
- Авксентьев, Николай Александрович. : [ англ. ] / Николай Александрович Авксентьев, М. Ю. Фролов, А. С. Макаров // Эффективная фармакотерапия : журн. — 2019. — Т. 15, № 24. — С. 38–46. — doi : .
Документы
- Алиева, Н. А. : Регистрационный номер ЛП-003972 / ООО «МСД Фармасьютикалс». — Министерство здравоохранения Российской Федерации, 2016. — 18 ноября. — 19 с.
- : Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2018 год, перечня лекарственных препаратов для медицинского применения, перечня лекарственных препаратов, предназначенных для обеспечения лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, а также лиц после трансплантации органов и (или) тканей, а также минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи.
Ссылки
- . Китруда® . Государственный реестр лекарственных средств . Минздрав РФ (18 ноября 2016).
- . Новости GMP (27 октября 2017). — «Иммуноонкологический препарат пембролизумаб включен в утвержденный Перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) на 2018 год. Соответствующее распоряжение от 23 октября 2017 года №2323-р размещено на сайте Правительства РФ.» Дата обращения: 30 августа 2019. 30 августа 2019 года.
- . Study Record Detail (англ.) . ClinicalTrials.gov . U. S. National Library of Medicine (2 апреля 2019). — NCT01295827. Дата обращения: 30 августа 2019. 30 августа 2019 года.
- . Компания MSD подала заявку на включение иммуноонкологического препарата пембролизумаб (Китруда) в перечень жизненно важных. Стоимость лекарства на коммерческом рынке составляет 245 тысяч рублей за 100 мг. (англ.) . Vademecum (25 апреля 2017). Дата обращения: 30 августа 2019. 30 августа 2019 года.
- MeSH
- 2020-12-31
- 1