Interested Article - Реакционный центр

- 2020-03-17
- 1

Реакционный центр — комплекс белков, пигментов и других кофакторов , взаимодействие которых обеспечивает реакцию превращения энергии света в химическую при фотосинтезе . Реакционный центр получает энергию или через непосредственное возбуждение одной из своих молекул или через перенос энергии от светособирающих комплексов , что даёт начало цепочке химических реакций, происходящей на связанных белками кофакторах. Эти кофакторы — светопоглощающие молекулы (также именуемые хромофорами или пигментами ) такие как хлорофилл , феофитин и хиноны . Энергия фотона используется для поднятия электрона на более высокий энергетический уровень . Запасённая таким образом свободная энергия идёт на восстановление цепочки акцепторов электрона с более высоким редокс-потенциалом .
Реакционные центры есть у всех фотосинтезирующих организмов: зелёных растений , водорослей и многих бактерий . Несмотря на то, что разные виды разделены миллиардами лет эволюции, реакционные центры у всех видов гомологичны , в то время как светособирающие комплексы весьма разнообразны. Всего выделяют четыре основных типа реакционных центров, включающих пигменты — П 700 (у высших растений в фотосистеме I ), П 680 (у высших растений в фотосистеме II ), П 870 (у пурпурных бактерий ) и П 840 (у зелёных серобактерий ). Фотосистемы являются большими белковыми суперкомплексами, окружёнными множеством светособирающих антенн.
Трансформация энергии света в энергию разделения зарядов
Реакционные центры есть у всех зелёных растений , водорослей и многих бактерий . Лучше всего изучен реакционный центр бактерии Rhodopseudomonas : это был первый реакционный центр с полностью расшифрованной структурой, что облегчалось отсутствием у него большого количества дополнительных субъединиц .
Реакционный центр устроен таким образом, чтобы эффективно поглощать энергию света и трансформировать её в химическую форму. После поглощения энергии хлорофиллы испускают пару электронов, которые поступают в ЭТЦ .
Согласно квантовой теории Эйнштейна свет состоит из мельчайших частиц, несущих порции энергии — фотонов . Если фотон с достаточным количеством энергии поглотится электроном, то электрон может перейти на новый энергетический уровень . Наиболее стабильное состояние электронов — на их самом нижнем энергетическом уровне. В этом состоянии электрон занимает орбиталь с наименьшим количеством энергии . Высокоэнергетические электроны могут вернуться в своё исходное состояние, подобно тому, как мяч катится вниз с лестницы. В ходе этого процесса электрон теряет энергию. Именно этот процесс и используется в реакционном центре.
Электронное возбуждение молекулы хлорофилла а приводит к уменьшению окислительно-восстановительного потенциала , то есть молекула легче отдает электроны, что является ключевым фактором в преобразовании энергии электронного возбуждения в химическую. Зелёные растения имеют многочисленные акцепторы электронов, упорядочены в цепь электронного транспорта , куда входят феофитин , хинон , пластохинон , цитохром-b6f-комплекс и ферредоксин . Завершает цепочку восстановление молекулы НАДФН . Прохождение электрона через цепь переноса электронов приводит к закачке протонов из стромы хлоропласта в люмен, благодаря чему образуется градиент протонов на тилакоидной мембране, который клетка может использовать для синтеза АТФ с использованием АТФ-синтазы . Как НАДФН , так и АТФ используются в цикле Кальвина для фиксации углерода .
Бактерии
Структура
Определение структуры реакционных центров бактерий стало важным шагом на пути понимания химии биологических процессов и усвоения световой энергии. В конце 1960-х годов Дэн Рид и первыми выделили фракцию реакционных центров пурпурной бактерии . Кристаллическую структуру впервые определили в 1982 году Хартмут Михель , Иоганн Дайзенхофер и Роберт Хубер , за что в 1988 году получили Нобелевскую премию . Это открытие было особо важным ещё и потому, что реакционный центр фотосистемы бактерий стал первым мембранным комплексом с расшифрованной структурой.
Реакционный центр пурпурных бактерий состоит из трёх субъединиц. Субъединицы L и M пронизывают двойной липидный слой мембраны. Структурно они похожи между собой, обе имеют пять трансмембранных альфа-спиралей , четыре бактериохлорофилла b ( BChl-b ), два b (BPheo), два хинона (Q A и Q B ) и ион железа между ними, связанный с субъединицами L и M. Субъединица H, показанная на картинке золотистым цветом, лежит с цитоплазматической стороны плазматической мембраны. Цитохромная субъединица, не показанная на рисунке, содержит четыре гема с-типа и лежит на внешней поверхности мембраны. Наличие этой субъединицы в бактериях не обязательно. Основную роль в работе фотосистемы играют коровые субъединицы L и M, связывают функциональные кофакторы и хлорофиллы .

Реакционные центры разных видов бактерий могут иметь несколько разные бактериохлорофиллы и бактериофеофитины. Благодаря этой изменчивости меняется спектр света, который поглощают бактерии, а это способствует образованию особых ниш фотосинтеза . Реакционный центр состоит из димера бактериохлорофилла а, выполняющего функцию сбора и передачи энергии поглощенного фотона, и бактериофеофитина, который первым принимает на себя электрон, осуществляя первичное разделение зарядов. BChl напоминает по строению молекулу хлорофилла зеленых растений, но, благодаря небольшим структурным различиям, имеет пик поглощения в инфракрасной области с длиной волны до 1000 нм. Bpheo имеет почти то же строение, что и BChl, но центральный атом магния в нём замещен двумя протонами . Это замещение приводит как к изменению максимума поглощения, так и к уменьшению окислительно-восстановительного потенциала.
Механизм

Процесс начинается, когда свет поглощается двумя молекулами BChl (димером) на периплазматической стороне мембраны. Эта пара, именуемая специальной парой , поглощает фотоны с длиной волны 870 и 960 нм в зависимости от вида, а потому её называют П 870 (у ) или П 960 ( ). После поглощения фотона на субъединице L происходит разделение зарядов и перенос электрона от Bchl на BPheo. Пигмент остается положительно заряженным, тогда как BPheo получает отрицательный заряд перенесённого электрона. Этот процесс длится примерно 10 пкс (10 −11 секунд) .
На этой стадии заряды специальной пары П 870 + и BPheo - могут рекомбинировать. При этом энергия высокоуровневого электрона будет растрачена на тепло. Реакционный центр имеет несколько механизмов предотвращения этого нежелательного процесса. Так, возврат электрона с BPheo - на П 960 + происходит довольно медленно по сравнению с другими реакциями. Намного быстрее протекает реакция переноса электрона от BPheo - (BPheo - окисляется до BPheo) на хинон (Q A ), а P 960 + в свою очередь забирает электрон от гема с цитохромной субъединицы над реакционным центром (П 960 + восстанавливается до П 960 ).
Высокоэнергетический электрон, локализованный на прочно связанной молекуле хинона Q A , переходит к молекуле хинона Q B . Эта молекула слабо ассоциирована с белком и легко отрывается. Для того, чтобы полностью восстановить Q B в QH 2 , нужны два высокоэнергетических электрона. При этом два протона берутся из цитоплазмы . Восстановленный хинон QH 2 диффундирует через мембрану к другому белковому комплексу — цитохром-bc1-комплексу , где происходит его окисление. В этом процессе восстановительный потенциал QH 2 используется для того, чтобы закачать два протона через мембрану в периплазматическое пространство . Электроны переходят из комплекса bc 1 на маленький водорастворимый белок цитохром c 2 , который переносит их к цитохромной субъединице, обеспечивая цикличность транспорта электронов .
По аналогичному принципу построен реакционный центр зелёных серобактерий , который близок фотосистеме I . Однако, в отличие от реакционного центра пурпурных бактерий, описанного выше, ФС зелёных серобактерий осуществляет линейный, а не циклический транспорт электронов, окисляя сероводород или тиосульфат и восстанавливая ферредоксин .
У зелёных серобактерий реакционный центр состоит из пяти субъединиц: PscA-D. Две субъединицы PscA димеризуются и вместе удерживают кофакторы (одну специальную пару П 840 , бактериохлорофилл а и филлохинон на каждой PscA и один железосерный кластер Fx между ними), при этом каждая из них связывает по одной копии PscD и PscC, последняя несёт на себе гем. Субъединица PscB помещается в центре димера и связывает два железосерных кластера, которые передают электроны на ферредоксин [ значимость факта? ] .
Зелёные растения
Оксигенный фотосинтез
В 1772 году химик Джозеф Пристли провёл цикл экспериментов с газами, которые принимают участие в процессах дыхания и горения. В первом эксперименте от зажег свечу и поместил её под перевёрнутый сосуд. Через некоторое время свеча погасла. Далее он провел аналогичный эксперимент с мышкой. Мышь умерла вскоре после того, как погасла свеча. Оказалось также, что воздух можно оживить, если поместить в герметичную ёмкость зелёные растения, предоставив им доступ к свету. Наблюдение Пристли были одной из первых демонстраций деятельности фотохимических реакционных центров.
В 1779 Ян Ингенхауз провёл свыше 500 экспериментов в течение четырёх месяцев в попытке объяснить феномен, открытый Пристли. Он записывал свои открытия в книгу, озаглавленную «Эксперименты над овощами». Ингенхауз брал зелёные растения и погружал их в прозрачную ёмкость с водой. Он увидел множество пузырьков, поднимавшихся к поверхности с листьев растений, каждый раз когда растение выставляли на свет. Он собрал этот газ и провёл несколько экспериментов, чтобы определить его химическую природу. Эксперименты выявили способность газа возобновлять горение тлеющей лучины, то есть оказалось, что это был кислород или, как называл его Джозеф Пристли, «де- флогистонирующий воздух».
В 1932 году профессор Роберт Эмерсон и студент использовали методику вспышек, чтобы точно измерить небольшие количества кислорода, произведенного хлорофиллом водоросли Chlorella . Своими экспериментами они доказали существование фотохимического центра. Позже Гаффрон и Воль объяснили результаты опыта, поняв, что энергия света, поглощенная хлорофиллом, передается в место , которое получило название фотохимического центра фотосистемы II. Такой процесс присущ цианобактериям , водорослям и зелёным растениям .
Фотосистема II
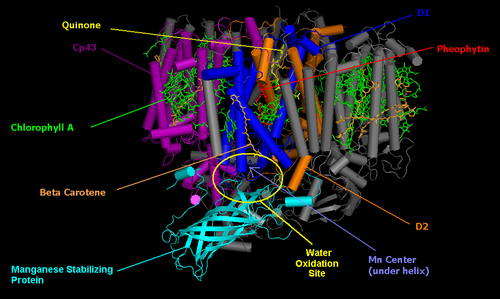
Фотосистема II производит два электрона, предназначенные для восстановления НАДН + при помощи фермента . Она содержится в тилакоидных мембранах внутри хлоропластов , где в зелёных растениях протекает фотосинтез . По своему строению она удивительно похожа на фотохимический центр пурпурных бактерий , что позволяет предположить существование общего предка.
Ядро фотосистемы II состоит из двух субъединиц, именуемых D1 и D2. Эти две субъединицы аналогичны субъединицам L и M фотохимических центров бактерий . Она отличается от субъединиц бактериальных центров наличием множества дополнительными субъединиц с хлорофиллами , что повышает её эффективность. Суммарную реакцию, протекающую в фотосистеме II, можно записать как:
,
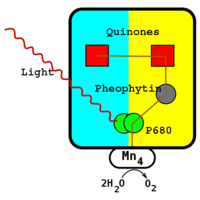
где Q обозначает пластохинон , а QH 2 — его восстановленную форму. Процесс восстановления хинона похож на аналогичный процесс в фотохимических центрах бактерий . Фотосистема II получает электрон от воды посредством фотохимического окисления. Побочным продуктом этого процесса является молекулярный кислород , и именно благодаря этому зелёные растения обогащают кислородом атмосферу Земли . Тот факт, что кислород , который производят зелёные растения, берется из воды, первым доказал американский биохимик канадского происхождения . Для того, чтобы отследить путь атома кислорода от воды до молекулярного кислорода, он использовал природный стабильный изотоп кислорода 18 O. Реакцию фотохимического окисления воды в фотохимическом центре фотосистемы II катализирует белковый комплекс с четырьмя ионами марганца .
Как и в фотохимическом центре бактерий , процесс начинается с поглощения света парой молекул хлорофилла. Зелёные растения используют хлорофилл a , а не бактериохлорофилл а, благодаря чему поглощают свет с меньшей длиной волны. Пару хлорофиллов фотохимического реакционного центра часто обозначают в соответствии с их максимум поглощения как П 680 . После поглощения фотона электрон с высокой энергией переходит к молекуле феофитина . От молекулы феофитина он переходит на две молекулы пластохинона — одну прочно прикрепленную, вторую связанную слабо, аналогично тому, как это происходит в бактериальных реакционных центрах. Для полного восстановления слабо связанной молекулы пластохинона требуется два высокоуровневых электрона и два протона из стромы .
Фотосистема II отличается от реакционного центра бактерий источником электронов, восстанавливающих пару молекул хлорофилла a. В бактериях электроны берутся с восстановленной группы гема цитохромной субъединицы или с растворимого в воде белка цитохрома c 2 .
После завершения процесса разделения заряда молекула П 680 остается положительно заряженной. Она является очень сильным окислителем и отбирает два электрона у молекул воды, ассоциированных с марганцевым центром, расположенным неподалеку. Кроме четырёх ионов марганца этот центр содержит ион кальция , ион хлора и тирозиновый остаток. Эффективность марганца обусловлена тем, что он имеет четыре состояния окисления: Mn 2+ , Mn 3 + , Mn 4+ и Mn 5+ . Кроме того марганец хорошо связывается с соединениями, содержащими кислород, например, с водой.
Поглощая фотон, П 680 теряет электрон и получает положительный заряд. Этот заряд нейтрализуется путём получения электрона от марганцевого центра. Для окисления воды нужно четыре электрона. Именно молекулы воды является источником электронов, восстанавливающих две молекулы Q к QH 2 . Такой каталитический центр расщепления воды до сих пор не удается воссоздать никакими искусственными методами.
Фотосистема I
Покинув фотосистему II, электрон переносится на цитохром-b6f-комплекс , а от него — на белок пластоцианин . Пластоцианин диффундирует в люмене к следующему реакционному центру — фотосистеме I и переносит электрон.
Как и в фотосистеме II и реакционном центре бактерий , процесс начинается с пары молекул хлорофилла a , в которой происходит фотоиндуцированное разделение заряда. Эту пару называют П 700 , где 700 означает длину волны максимального поглощения молекул хлорофилла. П 700 расположена в центре молекулы белка. После разделения заряда электрон переносится через транспортную цепочку в молекулы хлорофилла a , к молекуле хинона, через три железосерных кластера 4Fe-4S на ферредоксин . Ферредоксин является растворимым белком, содержащим кластер 2Fe-2S, координированный четырьмя цистеиновыми остатками. Положительный заряд, оставшийся на П 700 , нейтрализуется переносом электронов электронов от пластоцианина . Общая формула реакции в фотосистеме I имеет вид:
Взаимодействие между фотосистемами I и II создает поток электронов от H 2 O до НАДФ + . Его называют Z-схемой фотосинтеза, поскольку редокс-диаграмма пути переноса электрона от П 680 до П 700 похожа на букву Z .
См. также
Примечания
Статьи
- ↑ от 31 мая 2010 на Wayback Machine , Chapter 19.
- от 9 мая 2015 на Wayback Machine (2000). Retrieved Feb 28, 2010.
- Arie Uittenbogaard (2005). от 8 февраля 2015 на Wayback Machine Retrieved Feb 28, 2010.
- Reed, D. W., & Clayton, R. K. (1968). Isolation of a reaction center fraction from Rhodopseudomonas spheroides. Biochemical and biophysical research communications , 30 (5), 471—475.
- X-Ray Structure Analysis of a Membrane Protein Complex. Electron Density Map at 3 Angstroms Resolution and a Model of the Chromophores of the Photosynthetic Reaction Center from Rhodopseudomonas Viridis. Deisenhofer et al. J.MOL.BIOL. vol:180, pag:385 (1984)
- . Дата обращения: 7 февраля 2015. 28 марта 2014 года.
- Hauska G , Schoedl T , Remigy Hervé , Tsiotis G. // Biochimica et Biophysica Acta (BBA) - Bioenergetics. — 2001. — Октябрь ( т. 1507 , № 1-3 ). — С. 260—277 . — ISSN . — doi : .
- Mohammad Yunus et al. (2000). от 24 мая 2014 на Wayback Machine . Retrieved Feb 28 2010.
- Gary E. Kaiser (Feb. 24, 2003) Bacterial growth and microbial metabolism. Retrieved Feb 28 2010.
- 3 августа 2003 года. (10 August 2003) Ultranet biology
- Jagannathan, Bharat; Golbeck, John. Photosynthesis: microbial (англ.) // Encyclopedia of Microbiology 3rd Ed : book. — 2009. — P. 325—341 . — doi : .
- от 25 июня 2014 на Wayback Machine , by Rajni Govindjee. Retrieved Feb 28 2010.
Источники
- Jeremy M. Berg et al. (2002). ISBN 0-7167-4684-0
- Robin Ghosh et al. . URL accessed on February 28, 2010.
- . URL accessed on February 28, 2010.
- Kimberley A. McGrath et al. (1999). World of biology ISBN 0-7876-3044-6
Ссылки
- — Calculated spatial positions of photosynthetic reaction centres and photosystems in membrane
- - Photosynthesis and all sub categories
- 2020-03-17
- 1




