Interested Article - Ферроцен
- 2021-10-07
- 1


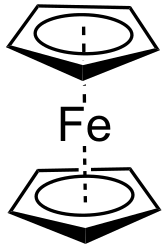
Ферроцен — одно из наиболее известных металлоорганических соединений, представитель класса сэндвичевых соединений ( металлоценов ). Номенклатурное название: бис-η 5 -циклопентадиенилжелезо(II) (η 5 -С 5 Н 5 ) 2 Fe.
Оранжевые кристаллы . Ферроцен возгоняется при атмосферном давлении; растворим в органических растворителях, нерастворим в воде; устойчив к действию воздуха, горячей концентрированной соляной кислоты и растворам щелочей .
Открытие

В 1951 году Т. Кили и П. Посон, провели реакцию C 5 H 5 MgBr c хлоридом железа FeCl 3 с целью синтезировать новый углеводород — дициклопентадиенил. Неожиданно они получили совершенно новое, исключительно устойчивое жёлто-оранжевое кристаллическое соединение , содержащее железо . Потребовалось около года, чтобы понять, как оно построено. Было обнаружено, что атом железа расположен посередине между двумя симметричными пятичленными кольцами C 5 H 5 . Пятичленные кольца в молекуле свободно вращаются вокруг оси, соединяющей центры колец. Такой тип структуры получил название «сэндвичевый». Из-за сходства реакционной способности с бензолом, новое соединение было названо «ферроцен» (звуковая аналогия очевидна в английском языке: benzene — ferrocene). Структура ферроцена была установлена в 1952 году Р. Вудвордом и Дж. Уилкинсоном на основании его реакционной способности, и независимо от них — Э. Фишером на основании рентгеноструктурных данных.
Свойства
Многими исследователями было показано, что по общему характеру реакционной способности ферроцен напоминает бензол; это привело к тому, что очень скоро после открытия ферроцен был назван небензоидной ароматической системой. Для него характерны три типа химических превращений: замещение водорода в С 5 Н 5 -кольцах без разрыва связей Fe—Сp (Cp=С 5 Н 5 ), окисление по атому Fe и разрыв связи Fe—Cp.
Реакции электрофильного замещения для ферроцена протекают легче, чем для бензола; при этом образуются как моно-, так и гетероаннулярные (содержащие заместители в разных циклах) дизамещённые производные.
Ферроцен легко и обратимо окисляется до катион - радикала ферроцения ( кислородом воздуха в кислой среде, перекисью водорода , иодом , хлоридом железа(III) и т. п.). При окислении не происходит заметных изменений в геометрии молекулы ферроцена. Разбавленные растворы солей ферроцения окрашены в синий цвет, концентрированные — в красный.
Связь Fe—Сp в ферроцене мало реакционноспособна и разрывается только при действии очень сильных восстановителей: водорода в присутствии катализатора ( никель Ренея ) (300 °C, 2.5 МПа) либо растворов щелочных металлов в жидком аммиаке или аминах. При взаимодействии ферроцена с аренами в присутствии AlCl 3 /Al одно кольцо замещается на арен и образуется катион [Fе(С 5 Н 5 )(Ar)] + .
Получение
- Реакция хлорида железа с реактивом Гриньяра :
- Реакция циклопентадиена с пентакарбонилом железа :
- Реакция циклопентадиена с хлоридом железа и диэтиламином :
Применение
Ферроцен используется в нефтяной промышленности в качестве антидетонатора . Применяется как термостабилизатор полиэтилена и диеновых каучуков (например, бутадиеновых); используется в синтезе некоторых медицинских препаратов.
Примечания
Литература
- Фишер Э., Вернер Г. «π-комплексы металлов», М.: Мир, 1968.
- Посон П. «Химия металлоорганических соединений», М.: Мир, 1970.
- Губин С. П., Шульпин Г. Б. «Химия комплексов со связями металл — углерод», Новосибирск, Наука, 1984.
Ссылки
- 2021-10-07
- 1

![{\displaystyle {\mathsf {Fe(CO)_{5}+C_{5}H_{6}\ {\xrightarrow[{-CO,-H_{2}}]{200^{o}C}}\ Fe(C_{5}H_{5})(CO)_{2}\ {\xrightarrow[{-Fe_{3}(CO)_{12}}]{T}}\ Fe(C_{5}H_{5})_{2}}}}](/images/005/814/5814235/7.jpg?rand=861716)

