Interested Article - Реальный раствор

- 2021-12-08
- 1
Реальный раствор — гомогенная смесь двух или более компонентов, образование которой сопровождается тепловым эффектом (выделением или поглощением тепла) и изменением объема. Это объясняется (в отличие от идеального раствора ) различной Ван-дер-Ваальсовой энергией межмолекулярного взаимодействия между однородными и разнородными молекулами.


Реальные растворы не подчиняются
закону Рауля
(здесь
P
— парциальное давление пара компонента над раствором,
— давление пара над чистым компонентом,
x
— его мольная доля в растворе), причём различают положительные и отрицательные отклонения от этого закона – см. рисунки 1 и 2. На них сплошными кривыми обозначена зависимость парциальных давлений паров компонентов от состава бинарного раствора, длинным пунктиром –
закон Рауля
, коротким пунктиром –
закон Генри
; пунктирными полукругами обозначены области
предельно разбавленных растворов
.
При этом
закон Рауля
продолжает выполняться в области предельного разбавления. В предельно разбавленном растворе по другому компоненту выполняется
закон Генри
:
,
где K – константа Генри.

В идеальных растворах закон Рауля выполняется во всём интервале концентраций, и константа Генри равна давлению пара P o над чистым компонентом; в реальных растворах К ≠ P o .
Чтобы можно было использовать формулу
закона Рауля
для реальных растворов,
Льюис
предложил заменить в ней мольную долю компонента (Х) на его "активность" (a). Отношение активности компонента к его мольной доле называют коэффициентом активности:
. Таким образом, зависимость давления пара компонента от его концентрации в реальном растворе выражается формулой
.
Коэффициент активности связан с энтальпией ΔH и "некомбинаториальной" энтропией ΔS образования раствора формулой
.
Дробь под экспонентой является функцией мольной доли x . Если обозначить её как f(x) и φ(y) для первого и второго компонента соответственно (здесь y=1–x — мольная доля второго компонента), то зависимость давления паров компонентов от состава раствора будет выражаться формулами
;
Тогда уравнение Гиббса-Дюгема принимает вид [4]
,
а закон Рауля –
,
т.е закон Рауля является следствием уравнения Гиббса-Дюгема при условии справедливости равенств
.
В работе показано, что если функции f(x) и φ(y) аппроксимировать полиномами пятой степени
и
и ввести обозначения
; ; ;
где W i — вторые вириальные коэффициенты компонентов в растворе, — мольные объемы чистых компонентов, то коэффициенты полиномов принимают вид:
Уравнения (1)–(4) хорошо согласуются с экспериментальными данными, включая расслаивающиеся растворы.
В случае и уравнения (1)–(4) переходят в уравнения Маргулеса , а если дополнительно потребовать , то в уравнения Ван-Лаара , т.е. уравнения Маргулеса и Ван-Лаара являются частными случаями уравнений (1)–(4).
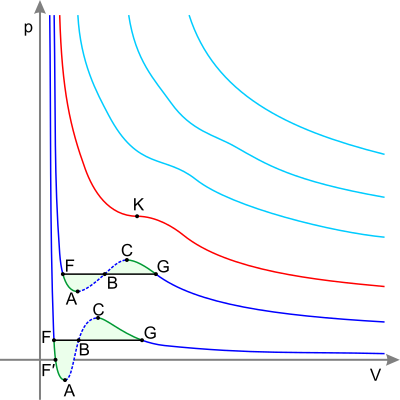
При некоторых значениях параметров зависимости приобретают экстремальный характер (см. рис.3), что означает расслоение раствора (интервал расслоения на рис.3 от до ). При этом интервал расслоения определяется по кривым , исходя из следующих соображений : давление пара каждого компонента на левой границе интервала расслоения равно давлению его пара на правой границе (пунктирные линии на рис.3).
Примечания
- Левинский А.И. Зависимость парциальных давлений паров от состава бинарного раствора (рус.) // Журнал физической химии. — 1990. — Т. 64 , № 5 . — С. 1388-1391 .
- Коган В.Б., Фридман В.М., Кафаров В.В. Равновесие между жидкостью и паром.. — М.: "Наука", 1966. — С. 110, 650.
- Мелвин-Хьюз Э.А. Кн. 2. // Физическая химия. — Изд-во иностр. лит., 1962. — С. 690.
- Левинский А.И. Существуют ли бинарные растворы с двумя областями расслоения? // Журнал физической химии. — 2002. — Т. 76 , № 1 . — С. 134-135 .
Литература
- Физическая химия под ред. д.х.н. проф. К.С. Краснова. М., "Высшая школа", 2001, том 1, стр. 400.
- Герасимов Я.И. Курс физической химии. М., "Химия", 1964. том 1, стр. 191.
- Мелвин-Хьюз Э.А. Физическая химия. М., Изд-во иностранной литературы, 1962, Кн. 2, стр. 690.
- Левинский А.И. Журн. физ. химии. 1990, т. 64 №5, стр. 1388.
- Левинский А.И. Журн. физ. химии, 2002, т. 76 №1, с. 134-135.
- Коган В.Б., Фридман В.М., Кафаров В.В. Равновесие между жидкостью и паром. М.: Наука, 1966, стр. 110, 650.
- 2021-12-08
- 1








![{\displaystyle (1)\qquad P_{1}=P_{1}^{o}x\exp[f(x)]}](/images/005/974/5974135/12.jpg?rand=410624)
![{\displaystyle P_{2}=P_{2}^{o}y\exp[\varphi (y)]}](/images/005/974/5974135/13.jpg?rand=273605)