Interested Article - Тетрафторэтилен

- 2020-03-24
- 1
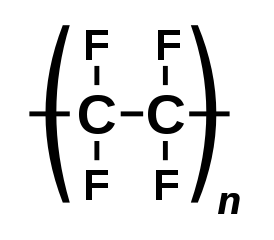
Тèтрафтòрэтиле́н — органическое соединение углерода и фтора с химической формулой , один из представителей фторолефинов — непредельных фторорганических соединений .
Представляет собой тяжёлый газ, плохо растворяется в воде .
Умеренно токсичен, ПДК р.з. 30 мг/м³, 4-й класс опасности (малоопасные вещества) по ГОСТу 12.1.007-76.
Физические и химические свойства
Тетрафторэтилен — тяжёлый газ (почти в 3,5 раза тяжелее воздуха), без цвета и запаха.
Молекула тетрафторэтилена плоская, межъядерное расстояние C—C — 1,33±0,06 Å, межъядерное расстояние C−F — 1,30±0,02 Å, угол между связями F—C—F — 114±3° .
Тетрафторэтилен является мономером многих полимеров ( пластмасс ), легко полимеризуется и сополимеризуется практически со всеми мономерами: этиленом , пропиленом , фтористым , трифторхлорэтиленом и другими, образуя фторопласты часто с уникальными свойствами .
Получение тетрафторэтилена
В лабораторных условиях тетрафторэтилен получают дебромированием цинком :
- ,
или деполимеризацией политетрафторэтилена в техническом вакууме :
- .
В промышленности тетрафторэтилен получают пиролизом хлордифторметана ( хладона-22 ) (при 550—750 °С) :
- .
Считается, что процесс пиролиза протекает через образование промежуточного дифторкарбена :
- ,
- .
Процесс пиролиза сопровождается образованием большого числа побочных продуктов: гексафторпропилена , октафторциклобутана и многих других.
Физические свойства
Стандартная энтальпия образования = −659,5 кДж/моль.
Теплота плавления 7,714 кДж/моль.
Пожароопасность
Класс опасности 4.
Тетрафторэтилен — горючий газ. Температура самовоспламенения 190 °C.
Чистый тетрафторэтилен — взрывоопасный газ при давлении выше 0,25 МПа. При этом происходит взрывная полимеризация:
Инициаторы взрыва: кислород, пероксидные соединения , оксиды металлов переменной валентности.
Жидкий тетрафторэтилен детонационными свойствами не обладает.
Химические свойства
На палладиевом катализаторе тетрафторэтилен присоединяет водород с образованием 1,1,2,2- тетрафторэтана :
- .
При освещении актиничным светом тетрафторэтилен подвергается галогенированию , например:
- .
В жёстких условиях тетрафторэтилен сгорает в кислороде, образуя тетрафторметан и диоксид углерода :
- .
При повышенной температуре тетрафторэтилен подвергается циклодимеризации с образованием октафторциклобутана :
- .
Пиролиз тетрафторэтилена сопровождается образованием гексафторпропилена . Считается, что образование гексафторпропилена основано на реакциях :
- .
На реакции пиролиза тетрафторэтилена основано промышленное производство важного фторсодержащего мономера — гексафторпропилена
Тетрафторэтилен легко полимеризуется по радикальному механизму в присутствии любых источников радикалов. Полимеризацию осуществляют как суспензионным, так и эмульсионным способом.
Получаемый политетрафторэтилен выпускается в виде различных марок: Ф-4, Ф-4ПН-90; Ф-4ПН-40; Ф-4ПН-20; Ф-4D и т. д.
Тетрафторэтилен вступает в реакцию радикальной сополимеризации с различными мономерами:
- с этиленом — фторопласт-40 (Ф-40);
- с гексафторпропиленом — фторопласт-4МБ (Ф-4МБ);
- с фтористым винилиденом — фторопласт-42 (Ф-42) .
Токсичность
Техника безопасности
Тетрафторэтилен — токсичное вещество . Является сосудистым ядом , раздражает слизистые оболочки глаз и органов дыхания, в высоких концентрациях вредно влияет на центральную нервную систему , вызывает отёк лёгких , имеет нефротоксическое действие .
ПДК р.з = 30 мг/м 3 ; ПДК м.р. = 6 мг/м 3 ; ПДК СС = 0,5 мг/м 3 .
Сферы применения
Тетрафторэтилен используется в основном для получения тефлона ( фторопласта-4 ).
См. также
Примечания
- (недоступная ссылка)
- (недоступная ссылка)
- (недоступная ссылка)
- Справочник химика. — 2-е изд., перераб. и доп.. — Л.-М.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 358. — 1072 с.
- ↑ Промышленные фторорганические продукты: справ. издание / Б. Н. Максимов, В. Г. Барабанов, И. Л. Серушкин и др.. — 2-е изд., пер. и доп.. — СПб. : Химия, 1996. — 544 с. — ISBN 5-7245-1043-X .
- ↑ Верещагина Н. С., Голубев А. Н., Дедов А. С., Захаров В. Ю. Российский химический журнал. Журнал Российского химического общества им. Д. И. Менделеева. — 2000. — Т. XLIV, выпуск 2. — С. 110—114.
- ↑ Нефедов О. М., Иоффе А. И., Менгинов Л. Г. Химия карбенов. — М. : Химия, 1990. — С. 254. — 304 с. — ISBN 5-7245-0568.
- ↑ Логинов Б. А. Удивительный мир фторполимеров. — М. , 2008. — 128 с.
- Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб. : АНО НПО «Профессионал», 2004. — 1142 с.
- 2020-03-24
- 1


![{\displaystyle {\ce {[-CF2-CF2-]}}_{n}\xrightarrow {600-700\ ^{\circ }{\text{C}},\ 130-700\ {\text{Па}}} n~{\ce {CF2=CF2}}}](/images/005/999/5999131/9.jpg?rand=524665)






![{\displaystyle {\ce {CF2CF2 + Br2 ->[h\nu] CF2BrCF2Br}}}](/images/005/999/5999131/16.jpg?rand=265039)