Interested Article - Карбонат бериллия

- 2020-12-31
- 2
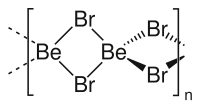
Карбонат бериллия — химическое соединение бериллия с химической формулой ВеСО 3 . Представляет собой бесцветное кристаллическое вещество (в порошке - белое). Карбонат бериллия не имеет запаха, но, как все соединения бериллия, обладает сладковатым вкусом.
Формы соединения
Карбонат бериллия существует в трех формах:
- средний карбонат (ВеСО 3 ) — при нормальных условиях неустойчив, разлагается на ВеО и углекислый газ , поэтому требует хранения в атмосфере СО 2 . ;
- тетрагидрат основного карбоната (ВеСО 3 •4Н 2 О) — при нормальных условиях сравнительно неустойчив, при нагревании разлагается.
- основной карбонат ([BeОН] 2 CO 3 ) — сравнительно устойчив на воздухе, при температуре выше 100°С быстро разлагается на ВеО , углекислый газ и воду. В воде плохорастворим.
Известны также гидратированные основные карбонаты переменного состава (ВеСО 3 • n Ве(OH) 2 • n Н2O, где n = 2, 3, 4, 5, 7; m = 1, 2, 3), выделяющиеся в виде плотного осадка из кипящих растворов.
Получение
- ВеСО 3 получают взаимодействием оксида бериллия и углекислого газа (при повышенном давлении):
- ВеСО 3 •4Н 2 О образуется при пропускании большого избытка СО 2 через раствор Ве(ОН) 2 (полученный осадок фильтруют и высушивают в атмосфере СО 2 ):
- [BeОН] 2 CO 3 может быть получен при взаимодействии растворимых солей бериллия (например, сульфата или хлорида бериллия ) и карбонатов щелочных металлов или аммония:
Химические свойства
- Все формы карбоната бериллия растворяются в избытке карбонатов щелочных металлов и аммония с образованием растворимых комплексных соединений. Например, возможны реакции:
Эти реакции представляют большой интерес в связи с возможностью их использования в аналитической химии для отделения бериллия от алюминия и железа, гидроксиды которых малорастворимы в карбонате аммония и практически нерастворимы в карбонатах щелочных металлов.
- При температуре выше 100 °C карбонат бериллия разлагается:
Примечания
- ↑ Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С.56
- ↑ Химия и технология редких и рассеянных элементов: Учеб. пособие для вузов: Ч. I / Под ред. К. А. Большакова. - 2-е изд., перераб. и доп.- М.: Высшая школа, 1976. - С.176.
- Egon Wiberg, Arnold Frederick Holleman Inorganic Chemistry. - Elsevier, 2001. - ISBN 0-12-352651-5
- 2020-12-31
- 2

![{\displaystyle {\mathsf {Be(OH)_{2}+CO_{2}+3H_{2}O\longrightarrow [BeCO_{3}\cdot 4H_{2}O]}}}](/images/006/093/6093860/3.jpg?rand=381820)
![{\displaystyle {\mathsf {2BeCl_{2}+2Na_{2}CO_{3}+H_{2}O\longrightarrow [BeOH]_{2}CO_{3}+4NaCl+CO_{2}}}}](/images/006/093/6093860/4.jpg?rand=687692)
![{\displaystyle {\mathsf {BeCO_{3}+(NH_{4})_{2}CO_{3}\longrightarrow (NH_{4})_{2}[Be(CO_{3})_{2}]}}}](/images/006/093/6093860/5.jpg?rand=248611)
![{\displaystyle {\mathsf {[BeOH]_{2}CO_{3}+3Na_{2}CO_{3}\longrightarrow 2Na_{2}[Be(CO_{3})_{2}]+2NaOH}}}](/images/006/093/6093860/6.jpg?rand=615072)

![{\displaystyle {\mathsf {[BeOH]_{2}CO_{3}+2H_{2}SO_{4}\longrightarrow 2BeSO_{4}+3H_{2}O+CO_{2}}}}](/images/006/093/6093860/8.jpg?rand=85634)

![{\displaystyle {\mathsf {[BeOH]_{2}CO_{3}\longrightarrow 2BeO+H_{2}O+CO_{2}}}}](/images/006/093/6093860/10.jpg?rand=701339)