Interested Article - Дисульфид титана

- 2020-01-08
- 1
Дисульфи́д тита́на — неорганическое соединение , соль переходного металла титана и сероводородной кислоты с формулой TiS 2 , относится к группе дихалькогенидов переходных металлов .
При обычных условиях — золотисто-жёлтые кристаллы со слабым запахом сероводорода , не растворимые в воде, реагирует с горячей водой с выделением сероводорода.
Применяется в качестве катодной массы электрохимических источников тока и аккумуляторов и в качестве твёрдого смазочного материала .
Получение
Синтезом из элементов:
- .
Нагреванием смеси паров тетрахлорида титана и сероводорода при высокой температуре, эта реакция пригодна для формирования тонких плёнок вещества на какой-либо подложке, реакция протекает в две стадии:
суммарная реакция:
- .
Действием сероводорода на элементарный титан при высокой температуре:
- .
Дисульфид титана образуется также при действии расплавленной серы на при 120°С:
- .
Действием сероводорода на тетрафторид титана при температуре красного каления:
- .
Дисульфид титана образуется при восстановлении сульфата титана(IV) водородом :
- .
Вместе с примесями дисульфид титана получается при пропускании очень медленного тока паров сероуглерода над нагретым спрессованным и высушенным диоксидом титана :
- .
Дисульфид титана также образуется при восстановлении сульфата титана(IV) водородом:
- .
Химические свойства
Разлагается при сильном нагревании без доступа воздуха:
- .
Восстанавливается при нагревании в атмосфере водорода сначала до степени окисления +3, а затем до степени окисления +2:
- .
Реагирует с расплавленными щелочами , пример реакции с гидроксидом калия с образованием титаната калия и сульфида калия :
- .
При нагревании реагирует с углекислым газом :
- .
При комнатной температуре диоксид титана устойчив к атмосферным воздействиям, но при умеренном нагревании на воздухе начинает окисляться до диоксида титана и диоксида серы . При сильном нагреве загорается:
- .
При реакции с горячей концентрированной серной кислоты образуется сульфат титанила , элементарная сера, сернистый газ и вода:
- .
При взаимодействии с холодной концентрированной азотной кислотой образует , серу, диоксид азота и воду:
- .
Реакция взаимодействия с концентрированной соляной кислотой образует и сероводород:
- .
Воcстановление активным металлом до элементарного титана в инертной атмосфере, например, в аргоне , активный металл окисляется до соответствующего сульфида:
- .
Физические свойства
Дисульфид титана при обычных условиях представляет собой золотисто-жёлтые, «бронзового» цвета чешуйчатые мелкие кристаллы, крупные кристаллы имеют золотистый цвет с зеленоватым оттенком, в мелкодисперсном виде после возгонки — бурый порошок . Диамагнетик .
Из-за взаимодействия с парами воды воздуха имеет слабый запах сероводорода. Не растворяется в холодной воде. Медленно реагирует с горячей водой. Огнеопасен, при сильном нагреве на воздухе загорается, выделяя диоксид серы .
Кристаллизуется в тригональной сингонии , пространственная группа P 3 m 1, параметры ячейки a = 0,3397 нм , c = 0,5691 нм , Z = 1 . Имеет слоистую кристаллическую структуру типа иодида кадмия .
При 1470 °C дисульфид претерпевает полиморфное превращение .
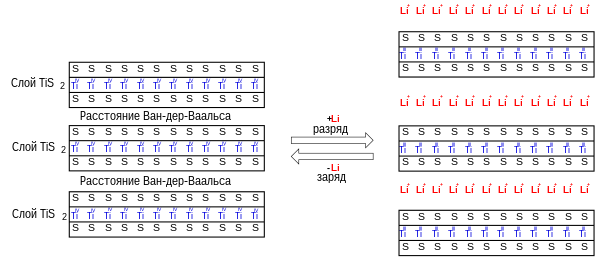
Атомы серы пространственно расположены в гексагональной плотной упаковке . Через каждые 2 плоских слоя атомов серы расположен плоский слой атомов титана, находящихся в октаэдрических полостях. Силы сцепления Ван-дер-Ваальса между двумя соседними слоями атомов серы малы и между слоями может происходить лёгкое скольжение, подобно скольжению слоёв атомов углерода в кристалле графита .
Теплоемкость дисульфида титана при 25 °C составляет 16,23 кал/(К·моль) или 55,4 Дж/(К·моль).
Стандартная теплота образования дисульфида титана составляет 80 ккал/моль.
Плотность дисульфида титана при 25 °C равна 3,22 г/см 3 .
Дисульфид титана является полупроводником с электронным типом проводимости c концентрацией носителей заряда ~10 21 см 3 и имеет высокую электропроводность характерную для полуметаллов .
Высокая электропроводность наряду с другими его свойствами обуславливает применение вещества в катодных массах литий-ионных аккумуляторов . Для увеличения электропроводности катодной массы в аккумуляторах его смешивают с сажей или графитом .

Дисульфид титана как и графит может обратимо интеркалировать и деинтеркалировать в свою кристаллическую структуру некоторые атомы и молекулы между слоями атомов серы так ка эти слои слабо связаны силами Ван-дер-Ваальса , например, атомы щелочных металлов , аммиак , гидразин , амиды кислот , при этом происходит «разбухание» кристаллической решётки с увеличением расстояния между кристаллическими слоями атомов. Дисульфид титана часто используется в качестве катодной массы в литий-ионных аккумуляторах и интеркаляция лития в это соединение изучена наиболее полно.
Интеркаляцию лития можно упрощённо описать в виде окислительно-восстановительной реакции :
- где может принимать значения от 0 до 1.
Соединение обычно записывают в ионной форме . На этом свойстве вещества основано его применение в качестве катодной массы аккумулятора как накопитель ионов лития. При разряде аккумулятора ионы внедряются в кристалл дисульфида титана. При разряде происходит обратный процесс.
Применение
Применяется в качестве катодной массы электрохимических источников тока и аккумуляторов и в качестве твёрдого смазочного материала .
Безопасность
Дисульфид титана относится согласно ГОСТ 12.1.005-88 к классу опасности III — вещества с умеренной степенью опасности. Предельно допустимая концентрация вещества в виде аэрозоля в воздухе производственных помещений 6 мг/м 3 . Требуется хранение с предосторожностями, так как вещество способно самовозгораться.
Примечания
- ↑
- Datenblatt Titan(IV)-sulfid bei AlfaAesar, abgerufen am 23. August 2011 ( ).
- . Дата обращения: 11 августа 2022. 11 августа 2022 года.
- Holleman A. F., Wiberg E., Wiberg N. Lehrbuch der Anorganischen Chemie. 91-100, verbesserte und stark erweiterte Auflage. de Gruyter, Berlin 1985, ISBN 3-11-007511-3 , S. 1065.
- Дата обращения: 11 августа 2022. 22 июня 2022 года.
- . Дата обращения: 11 августа 2022. 11 августа 2022 года.
- Дата обращения: 11 августа 2022. 1 апреля 2022 года.
- Whittingham M. S. Lithium Batteries and Cathode Materials. Chem. Rev. 104 (2004) 4273
- Brauer Georg (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Praparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , S. 1371.
- от 10 января 2020 на Wayback Machine ГОСТ 12.1.005-88. Система стандартов безопасности труда. Общие cанитарно-гигиенические требования к воздуху рабочей зоны.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4 .
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 2-е изд., испр. — М. — Л. : Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М. : Мир, 1972. — Т. 2. — 871 с.
- Tao, Y.; Wu, X.; Zhang, Y.; Dong, L.; Zhu, J.; Hu, Z. (2008). "Surface-assisted synthesis of microscale hexagonal plates and flower-like patterns of single-crystalline titanium disulfide and their field-emission properties". Crystal Growth & Design . 8 (8): 2990—2994. doi : .
- Zhang, Y.; Li, Z.; Jia, H.; Luo, X.; Xu, J.; Zhang, X.; Yu, D.J. (2006). "TiS 2 whisker growth by a simple chemical-vapor deposition method". Journal of Crystal Growth . 293 (1): 124—127. doi : .
- 2020-01-08
- 1
![{\displaystyle {\ce {Ti + 2S ->[{\ce {T}}] TiS2 + 335 kJ}}}](/images/006/228/6228813/4.jpg?rand=989714)
![{\displaystyle {\ce {TiCl4 + H2S ->[800-850\ {\ce {^{o}C}}] TiCl2S + 2HCl,}}}](/images/006/228/6228813/5.jpg?rand=333700)
![{\displaystyle {\ce {TiCl2S + H2S ->[800-850\ {\ce {^{o}C}}] TiS2 + 2HCl,}}}](/images/006/228/6228813/6.jpg?rand=493426)
![{\displaystyle {\ce {TiCl4 + 2H2S ->[800-850\ {\ce {^{o}C}}] TiS2 + 4HCl}}}](/images/006/228/6228813/7.jpg?rand=942364)
![{\displaystyle {\ce {Ti + 2H2S ->[{\ce {T}}] TiS2 + 2H2}}}](/images/006/228/6228813/8.jpg?rand=266624)
![{\displaystyle {\ce {TiOCl2 + 2S ->[120\ {\ce {^{o}C}}] TiS2{}+ Cl2O}}}](/images/006/228/6228813/9.jpg?rand=352850)
![{\displaystyle {\ce {TiF4 + 2H2S ->[{\ce {T}}] TiS2{}+ 4HF}}}](/images/006/228/6228813/10.jpg?rand=481192)



![{\displaystyle {\ce {2TiS2 ->[1000\ {\ce {^{o}C}}] Ti2S3 + S}}}](/images/006/228/6228813/14.jpg?rand=895485)
![{\displaystyle {\ce {2TiS2 + H2 ->[1000\ {\ce {^{o}C}}] Ti2S3 {+}H2S,}}}](/images/006/228/6228813/15.jpg?rand=531447)
![{\displaystyle {\ce {TiS2 + H2 ->[>1000\ {\ce {^{o}C}}] TiS + H2S}}}](/images/006/228/6228813/16.jpg?rand=3455)
![{\displaystyle {\ce {TiS2 + 6KOH ->[{\ce {T}}] K2TiO3 + 2K2S + 3H2O}}}](/images/006/228/6228813/17.jpg?rand=238339)
![{\displaystyle {\ce {TiS2 + 2CO2 ->[{\ce {T}}] TiO2 + 2S + 2CO}}}](/images/006/228/6228813/18.jpg?rand=578244)
![{\displaystyle {\ce {TiS2 + 3 O2 ->[{\ce {T}}] TiO2 + 2 SO2}}}](/images/006/228/6228813/19.jpg?rand=46295)
![{\displaystyle {\ce {TiS2 + 3 H2SO4 ->[{\ce {T}}] TiOSO4 + 2 S + 2 SO2 + 3 H2O}}}](/images/006/228/6228813/20.jpg?rand=362245)
![{\displaystyle {\ce {TiS2 + 6HNO3 ->[0\ {\ce {^{o}C}}] Ti(NO3)2(OH)2 + 2S + 4 NO2 + 2 H2O}}}](/images/006/228/6228813/21.jpg?rand=865382)

![{\displaystyle {\ce {TiS2 + 2 Ca ->[1000\ {\ce {^{o}C}}] 2 CaS + Ti,}}}](/images/006/228/6228813/23.jpg?rand=443655)