Interested Article - Хлорид сурьмы(III)

- 2021-12-27
- 1
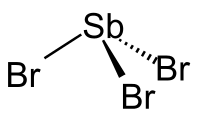
Хлорид сурьмы(III) — бинарное неорганическое соединение сурьмы и хлора с формулой SbCl 3 , бесцветные кристаллы, очень хорошо растворимые в холодной воде.
Получение
- Действие хлора на металлическую сурьму:
- Действием хлористого водорода на триоксид сурьмы :
- Действием хлора на триоксид сурьмы :
- Действием хлора на сульфид сурьмы :
Физические свойства
Хлорид сурьмы(III) образует бесцветные гигроскопичные диамагнитные кристаллы. Вызывает ожоги на коже. Очень хорошо растворимые в воде. Концентрированные водные растворы устойчивы и называются «сурьмяное масло» (едкая, жгучая, ядовитая жидкость). Разбавленные водные растворы подвергаются гидролизу.
Растворяется в хлороформе , четырёххлористом углероде , бензоле , диоксане и других органических растворителях.
Химические свойства
- Разлагается в разбавленных растворах или в горячей воде:
- В подкисленных растворах при нагревании реакция идёт иначе:
- Реагирует с соляной кислотой по-разному, в зависимости от её концентрации:
- Окисляется концентрированной азотной кислотой :
- Реагирует с разбавленными щелочами:
- и концентрированными:
- Хлором окисляется до пентахлорида сурьмы :
- Реагирует с сероводородом в кислой среде:
- С хлоридами щелочных металлов образует комплексные соли:
- Восстанавливается металлами в кислой среде:
Применение
- Для получения чистой сурьмы.
- Катализатор в органическом синтезе.
- Протрава при крашении тканей.
- Как неводный растворитель.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М. : Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4 .
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М. — Л. : Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0 .
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М. : Мир, 1971. — Т. 1. — 561 с.
- (англ.) : A CRC quick reference handbook — CRC Press , 1993. — ISBN 978-0-8493-4498-5
- 2021-12-27
- 1







![{\displaystyle {\mathsf {SbCl_{3}+HCl_{(15\%)}\ {\xrightarrow {}}\ H[SbCl_{4}]}}}](/images/006/438/6438639/11.jpg?rand=16785)
![{\displaystyle {\mathsf {2SbCl_{3}+3HCl_{(>20\%)}\ \xrightarrow {} \ H_{3}[Sb_{2}Cl_{9}]}}}](/images/006/438/6438639/12.jpg?rand=619243)
![{\displaystyle {\mathsf {SbCl_{3}+3HCl_{(36\%)}\ {\xrightarrow {}}\ H_{3}[SbCl_{6}]}}}](/images/006/438/6438639/13.jpg?rand=593018)


![{\displaystyle {\mathsf {SbCl_{3}+4NaOH\ {\xrightarrow {}}\ Na[Sb(OH)_{4}]+3NaCl}}}](/images/006/438/6438639/16.jpg?rand=779066)


![{\displaystyle {\mathsf {SbCl_{3}+2KCl\ {\xrightarrow {}}\ K_{2}[SbCl_{5}]}}}](/images/006/438/6438639/19.jpg?rand=545190)