Interested Article - Терефталевая кислота

- 2020-07-29
- 1
Терефталевая кислота (ТФК, 1,4-бензолдикарбоновая кислота) — двухосновная дикарбоновая ароматическая кислота с пара -расположением карбоксильных групп . Является изомером фталевой и изофталевой кислот.
Получение
Основным методом промышленного синтеза терефталевой кислоты является окисление п -ксилола в присутствии каталитической системы, содержащей кобальт , марганец и бром . Данная система обеспечивает практически полное количественное окисление метильных групп ксилола. Растворителем служит уксусная кислота , а окислителем является кислород воздуха. Источником брома могут быть бромоводород , бромид натрия , . Поскольку реакционная среда является коррозионноактивной, для синтеза используется титановое оборудование. Реактор работает при температуре 175—225 °C и давлении 1500—3000 кПа. Проводимая реакция весьма экзотермична .
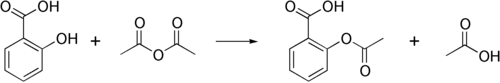
Схема реакции:

В качестве побочного продукта в небольших количествах образуются пара-толуиловая кислота и 4-карбоксибензальдегид. Для их отделения, а также для очистки продукта от окрашенных примесей, смесь подвергают гидрированию в присутствии палладиевого катализатора с последующей кристаллизацией . При этом 4-карбоксибензальдегид превращается в более растворимую в воде п -толуиловую кислоту , а окрашенные примеси превращаются в бесцветные вещества. В процессе кристаллизации осаждают менее растворимую терефталевую кислоту .
Терефталевую кислоту высокой чистоты в промышленности получают путём гидролиза диметилтерефталата . Для этого сложный эфир нагревают с водой до 260—280 °C при 4500—5500 кПа .
В лабораторных условиях терефталевую кислоту очищают через её натриевую соль, которую кристаллизуют из воды и затем превращают в кислоту подкислением минеральной кислотой .
Физические и химические свойства
Терефталевая кислота представляет собой белый кристаллический порошок, плохо растворимый в воде и уксусной кислоте, хорошо растворимый в растворах щелочей.
Проявляет свойства типичной карбоновой кислоты. В частности, при действии водоотнимающих агентов (например, уксусного ангидрида ) она превращается в полимерный ангидрид . При взаимодействии со спиртами терефталевая кислота даёт сложные эфиры , с основаниями она даёт соли, а реакция с оксихлоридом фосфора и тионилхлоридом приводит к .
Также терефталевая кислота вступает в реакции электрофильного замещения . Например, известны реакции её галогенирования в серной кислоте и сульфирования до моносульфопроизводного. Перегонка с оксидом кальция приводит к декарбоксилированию с образованием бензола .
Применение
Терефталевая кислота главным образом используется для получения насыщенных полиэфиров . Полиэтилентерефталат занимает 90 % от общего производимого количества этих полимеров. Годовая потребность в нём в 1992 году составила 12,6·10 6 т. Из этого количества примерно 75 % используется в текстильной промышленности и производстве промышленных волокон, ещё 13 % — для получения пищевых контейнеров (например, бутылок для напитков), причём этот процент постоянно растёт. Плёнка для фото, видео, аудиозаписей и фотографий занимает ещё 7 % от этого количества .
К другим областям применения терефталевой кислоты относятся производство полибутилентерефталата , используемого как промышленная изоляция , и диоктилтерефталата.
Учёные из из Эдинбургского университета при помощи генетически модифицированных бактерий Escherichia coli смогли переработать 79 % терефталевой кислоты в ванилин .
Безопасность
Терефталевая кислота обладает низкой токсичностью и лишь вызывает обратимое и мягкое раздражение глаз, кожи и дыхательной системы. Значения ЛД50 для неё составляют 18,8 г/кг (крысы), 6,4 г/кг (мыши). При внутрибрюшинном введении эти значения уменьшаются до 1,43 или, по другим данным, до 1,9 г/кг для крыс. ЛД100 при таком методе введения равно 3,2 г/кг .
Вдыхание взвесей терефталевой кислоты, по-видимому, не несёт большой опасности. Известно однако, что при достаточной концентрации вещества и наличии окислителя может происходить взрыв. Для терефталевой кислоты минимальное содержание должно составлять 40 г/м³ при концентрации кислорода 12,4 % .
Примечания
- Sigma-Aldrich. (неопр.) . Дата обращения: 7 июня 2014. 14 июня 2021 года.
- ↑ Химическая энциклопедия / Гл. ред. Н. С. Зефиров. — М. : Большая российская энциклопедия, 1995. — Т. 4. — С. 532.
- ↑ Sheehan R. J. Terephthalic Acid, Dimethyl Terephthalate, and Isophthalic Acid (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2011. — doi : .
- Armarego W. L. F., Chai C. L. L. Purification of Laboratory Chemicals. — 6th Ed.. — Elsevier, 2009. — С. 338. — ISBN 978-1-85617-567-8 .
- Joanna C. Sadler, Stephen Wallace . от 15 июня 2021 на Wayback Machine // The Royal Society of Chemistry, 2021
Ссылки
- Sigma-Aldrich. (неопр.) . Дата обращения: 7 июня 2014.
- Sigma-Aldrich. (неопр.) . Дата обращения: 7 июня 2014.
- Sigma-Aldrich. (неопр.) . Дата обращения: 7 июня 2014.
- 2020-07-29
- 1