Interested Article - Ангиотензинпревращающий фермент

- 2020-01-24
- 1
Ангиотензинпревращающий фермент , также CD143 (сокр. АПФ , англ. ACE ) — протеолитический фермент (экзопептидаза) (КФ ), циркулирующий во внеклеточном пространстве и катализирующий расщепление декапептида ангиотензина I до октапептида ангиотензина II. Обе формы ангиотензина играют важнейшую роль в ренин-ангиотензиновой системе , регулирующей кровяное давление в организме. Вторая важная функция АПФ — это инактивация брадикинина .
Будучи одним из ключевых элементов системы регуляции давления, АПФ является мишенью целого класса антигипертензивных средств — ингибиторов АПФ .
Ген ACE порождает два изофермента АПФ — соматический, обнаруживаемый во многих органах и тканях, и герминальный, присутствующий только в сперме.
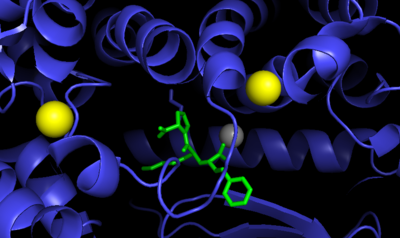
В активном центре АПФ находится атом цинка .
Механизм катализа
АПФ представляет собой цинк-зависимую металлопротеиназу . Цинковый центр катализирует гидролиз пептидов . Отражая критическую роль цинка, АПФ может ингибироваться металлохелатирующими агентами .

С точки зрения механизма катализа, аминокислотный остаток Glu-384 является критически важным. Как сопряжённое основание, он депротонирует связанную с цинком воду, образуя нуклеофильный центр Zn-OH. Образующаяся аммониевая группа затем служит сопряжённой кислотой для расщепления связи C-N .
Функция хлорид-иона (Cl - ) очень сложна и вызывает много споров. Активация анионами Сl - является характерной особенностью ACE. Экспериментально было установлено, что активация гидролиза хлорид ионами сильно зависит от субстрата . В то время как он увеличивает скорость гидролиза, например, последовательности Hip-His-Leu, он ингибирует гидролиз других субстратов, таких как Hip-Ala-Pro . В физиологических условиях фермент достигает около 60 % от своей максимальной активности в отношении ангиотензина I, в то же время, по отношению к брадикинину он достигает полной активности. Поэтому предполагается, что функция активации анионов в АПФ обеспечивает высокую субстратную специфичность . Согласно другим теориям, хлорид анионы могут просто стабилизировать всю структуру фермента .
Болезнь Альцгеймера и другие виды деменции
Один из полиморфизмов гена ACE ассоциирован с риском болезни Альцгеймера .
Исследования на животных трансгенных моделях позволяют предположить, что АПФ-ингибиторы, защищая сердечно-сосудистую систему , могут в то же время способствовать аккумуляции бета-амилоидных бляшек, поскольку АПФ расщепляет бета-пептид. На эту тему ведутся исследования . С другой стороны, АПФ-ингибиторы центрального действия снижают воспаление , тем самым, возможно, снижая риск деменции .
См. также
Примечания
- ↑ - Ensembl , May 2017
- ↑ - Ensembl , May 2017
- Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- (англ.) . РЛС® . Дата обращения: 4 мая 2023. 4 мая 2023 года.
- Wang W, McKinnie SM, Farhan M, Paul M, McDonald T, McLean B, et al. (August 2016). . Hypertension . 68 (2): 365—377. doi : . PMID . S2CID .
- Bünning P, Riordan JF (July 1985). "The functional role of zinc in angiotensin converting enzyme: implications for the enzyme mechanism". Journal of Inorganic Biochemistry . 24 (3): 183—198. doi : . PMID .
- Natesh R, Schwager SL, Sturrock ED, Acharya KR (January 2003). . Nature . 421 (6922): 551—554. Bibcode : . doi : . PMID . S2CID .
- ↑ Zhang C, Wu S, Xu D (June 2013). "Catalytic mechanism of angiotensin-converting enzyme and effects of the chloride ion". The Journal of Physical Chemistry B . 117 (22): 6635—6645. doi : . PMID .
- ↑ Bünning P (1983). "The catalytic mechanism of angiotensin converting enzyme". Clinical and Experimental Hypertension. Part A, Theory and Practice . 5 (7—8): 1263—1275. doi : . PMID .
- Lehmann D.J., Cortina-Borja M., Warden D.R., Smith A.D., Sleegers K., Prince J.A., van Duijn C.M., Kehoe P.G. (англ.) // : journal. — 2005. — August ( vol. 162 , no. 4 ). — P. 305—317 . — doi : . — .
-
Публикация и популярное объяснение на исследовательском сайте:
- Hemming M.L., Selkoe D.J. (англ.) // J. Biol. Chem. : journal. — 2005. — November ( vol. 280 , no. 45 ). — P. 37644—37650 . — doi : . — . — PMC . .
- от 26 октября 2007 на Wayback Machine — Форум исследования болезни Альцгеймера , 2005 год.
- Sink K.M., Leng X., Williamson J., Kritchevsky S.B., Yaffe K., Kuller L., Yasar S., Atkinson H., Robbins M., Psaty B., Goff D.C. (англ.) // : journal. — 2009. — July ( vol. 169 , no. 13 ). — P. 1195—1202 . — doi : . — . (недоступная ссылка)
Ссылки
- — medbiol.ru
- 2020-01-24
- 1