Простые эфиры
- 1 year ago
- 0
- 0

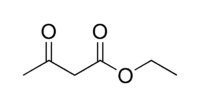
Ацетоуксусный эфир , этиловый эфир ацетоуксусной кислоты , этилацетоацетат — органическое соединение, сложный эфир, бесцветная подвижная жидкость с нерезким запахом, напоминающим сено или силос [ источник не указан 165 дней ] . Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром .
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия :
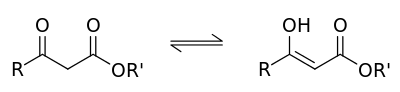 ,
,
Согласно правилу Эльтекова енольные формы карбонильных соединений неустойчивы. Однако в ряде случаев енольные формы могут быть достаточно стабильными. Например, енольный таутомер стабилизирован за счет образования сопряжённой системы (( H ):О—C(CH 3 )=C(H) —C(:OC 2 H 5 )= O : ; см. 2-ю формулу енольной формы на рис., R — CH 3 , R’ — C 2 H 5 ) и внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 % (кетонной — 92,5 %). Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная — вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (−80 °C — охлаждение сухим льдом ).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
При взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
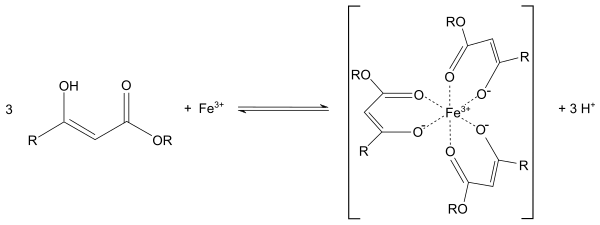
С металлами ацетоуксусный эфир образует хелаты , в которых ацетилацетат-анион выступает в роли бидентантного лиганда , так, с солями трехвалентного железа ацетоуксусный эфир образует окрашенный в пурпурный цвет комплекс:
Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированного аниона:
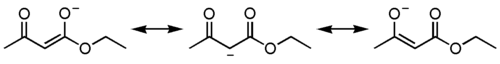
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия — в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир — широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
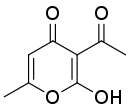
В безводных условиях в присутствии бикарбоната натрия ацетоуксусный эфир самоконденсируется с образованием дегидроацетовой кислоты :
2
|
→
|
| Ацетоуксусный эфир | Дегидроацетовая кислота |
Под действием серной кислоты на ацетоуксусный эфир происходит самоконденсация двух молекул эфира с замыканием α-пиронового цикла, ведущая к образованию .
Под действием водных кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксусной кислоты, которая в мягких условиях декарбоксилируется с образованием ацетона :
Аналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира ( кетонное расщепление ), эта реакция используется для синтеза замещенных метилкетонов.
Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты ( кислотное расщепление ), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира:
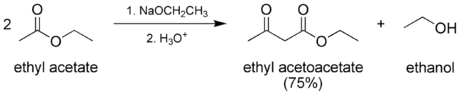
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсация этилацетата в присутствии этанола под действием металлического натрия , катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир :
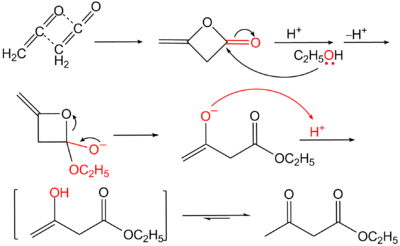
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном , этот метод является промышленным методом синтеза:
Ацетоуксусный эфир широко применяется в органическом синтезе.
Алкилирование натрийацетоуксусного эфира 2 с последующим кетонным либо кислотным расщеплением моно- и дизамещенных ацетоуксусныых эфиров 3 используется как препаративный метод синтеза метилкетонов 4 и замещенных уксусных кислот 5 :
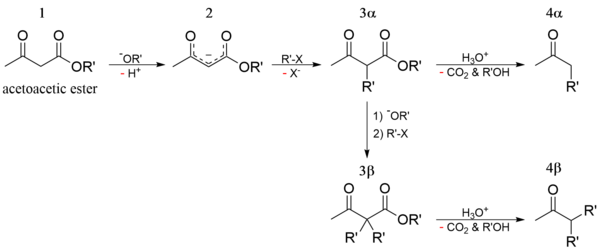
Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов ( пирамидона , акрихина , витамина B 1) , ряда органических веществ.
В фотографии использовался как жёлтая диффундирующая цветообразующая компонента, образующая краситель в процессе цветного фотографического проявления .
Ацетоуксусный эфир малоядовит : ЛД50 для крыс около 3895 мг/кг.
В больших количествах может обладать кожно-раздражающим действием. Всасывается через кожу. ПДК 10 мг/м³ по ГОСТ 12.1.007-76.