Interested Article - Флуоресценция хлорофилла

- 2020-09-05
- 1

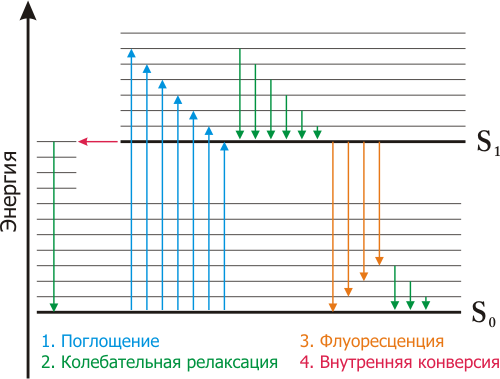
Флуоресценция хлорофилла — явление свечения хлорофилла при поглощении им света, происходит в результате возвращения молекулы из возбуждённого в основное состояние. Широко используется как показатель фотосинтетического преобразования энергии у высших растений , водорослей и бактерий . Возбуждённый хлорофилл теряет поглощённую световую энергию, растрачивая её на фотосинтез (фотохимические преобразования энергии или фотохимическое тушение), переводя её в тепло в результате нефотохимического тушения или излучая в виде флуоресценции. Поскольку все эти процессы конкурируют друг с другом, анализируя флуоресценцию хлорофилла, можно получить представления об интенсивности фотосинтеза и здоровье растения .
Эффект Каутского
После освещения адаптированных к темноте листьев, можно наблюдать быстрый рост флуоресценции Фотосистемы II (ФС II) за которым следует медленный спад. Впервые этот феномен описали Х. Каутский и А. Хирш в 1931 году. По имени своего первооткрывателя эффект был назван эффектом Каутского.
Увеличение флуоресценции происходит из-за того, что реакционные центры фотосистемы II (ФСII) переходят в «закрытое» состояние. Реакционный центр называется «закрытым», когда он больше не в состоянии передавать электроны. Это происходит, когда вышележащий переносчик электронов восстановлен и ещё не передал свои электроны следующему акцептору электронов. Закрытие реакционных центров снижает общую эффективность фотохимических реакций (kP), а потому повышает уровень флуоресценции (kF). Резкий перенос листа из темнового состояния на свет увеличивает долю закрытых реакционных центров ФСII и приводит к усилению флуоресценции в течение первых 1-2 секунд. Позже флуоресценция медленно ослабевает, этот процесс может идти в течение нескольких минут. Падение обусловлено активацией «фотохимического тушения» и переноса электронов от ФСII по ЭТЦ хлоропластов к НАДФ и циклу фиксации углерода, а также включением механизмов нефотохимического тушения , которое преобразует энергию возбуждения в тепло.
Измерения флуоресценции

Измерения начинают с определения фонового уровня флуоресценции , который измеряют, воздействуя на лист короткой вспышкой света низкой интенсивности (для приборов типа PAM), недостаточной что бы вызвать фотохимическую реакцию (все реакционные центры открыты), и потому полностью идущей на флуоресценцию .
Чтобы использовать измерение флуоресценции хлорофилла для анализа фотосинтеза, исследователи должны различать фотохимическое тушения и нефотохимическое тушение (тепловыделение). Это достигается путём остановки фотохимических реакций, что позволяет исследователям измерить флуоресценцию в присутствии только нефотохимического тушения. Для этого растение резко освещают сильной вспышкой света или выносят на свет после темновой адаптации. Происходит временное закрытие всех реакционных центров ФСII, и энергия не передаётся по цепи переносчиков электронов. Нефотохимическое тушение не оказывает влияния, если вспышка достаточно короткая. Во время вспышки (или после резкого выноса растения на свет из темноты) происходит насыщение реакционных центров светом с переходом в закрытое состояние. В таких условиях, когда отсутствует какое-либо фотохимическое тушение, а не фотохимическое тушение пренебрежительно мало, флуоресценции достигает своего максимального уровня, обозначаемого как максимум флуоресценции .
Эффективность фотохимического тушения, по которому определяют эффективность работы ФСII, можно оценить сравнивая со стационарным уровнем флуоресценции на свету и фоновый уровень флуоресценции в отсутствие света пригодного для фотосинтеза. Эффективность нефотохимического тушения изменяется в зависимости от различных внутренних и внешних факторов. Его усиление ведёт к повышению тепловыделения и снижению . Поскольку невозможно полностью остановит тепловую диссипацию энергии, то невозможно измерить флуоресценцию хлорофилла при полном отсутствии нефотохимического тушения. Поэтому исследователи используют точку темновой адаптации ( ) с которой сравнивают рассчитанное значение нефотохимическое тушения .
Общие параметры флуоресценции
: Минимальная флуоресценция (в относительных единицах). Уровень флуоресценции в условиях, когда предполагается, что все реакционные центры открытые (темновая адаптация).
: Максимальная флуоресценция (в относительных единицах). Уровень флуоресценции при вспышках высокой интенсивности. Все реакционные центры считаются закрытыми.
: Минимальная флуоресценция (в относительных единицах) в условиях адаптации к свету. Уровень флуоресценции облучаемого образца, который снижен по сравнению с из-за наличия нефотохимического тушения.
: Максимальная флуоресценция (в относительных единицах) в условиях адаптации к свету. Уровень флуоресценции образца, облучаемого насыщающими импульсами света, которые временно закрывают все реакционные центры ФСII.
: Терминальная флуоресценция (в относительных единицах). Тушение флуоресценции по состоянию на конец теста.
: Половина времени нарастания от до .
Расчётные параметры
: Вариабельная флуоресценция. Рассчитывается как = — .
: Отношение переменной флуоресценции и максимальной флуоресценции. Рассчитывается как . . Является мерой максимальной эффективности ФСII (если все центры были открыты). можно использовать для оценки потенциальной эффективности ФСII, если измерять образцы в условиях темновой адаптации.
: Фотохимическое тушение. этот параметр даёт приблизительную оценку доли открытых реакционных центров ФСII. Рассчитывается как .
: Эффективность фотохимических реакций фотосистемы II. Рассчитывается как = . Этот параметр показывает долю света, поглощённого ФСII, который использовался в фотохимических реакциях. Как таковой, он может дать измерение скорости линейного транспорта электронов и поэтому характеризует весь фотосинтез в целом.
даёт оценку эффективности фотосинтеза , а и говорят нам какие процессы влияют на эффективность. Закрытие реакционных центров в результате высокой интенсивности света изменит значение . Изменения в эффективности нефотохимического тушения изменит соотношение .
Практическое использование
Эффективность фотосистемы II как мера фотосинтеза

Флуоресценция хлорофилла используется для измерения уровня фотосинтеза, но по сути своей это чрезмерное упрощение. По флуоресценции можно измерить эффективность фотохимии ФСII, которую можно использовать для оценки скорости линейного транспорта электронов путём умножения на интенсивность света. Однако, когда исследователи говорят «фотосинтез», они обычно подразумевают фиксацию углерода . Транспорт электронов и фиксация CО 2 имею довольно хорошую корреляцию, но её может не наблюдаться в полевых условиях из-за таких конкурирующих процессов как фотодыхание , азотистый обмен и реакция Мелера .
Связь транспорта электронов с фиксаций углекислого газа
Для одновременного измерения флуоресценции хлорофилла и газообмена , чтобы получить полную картину реакции растений на их окружение необходима серьёзная и сложная исследовательская техника. Один из методов заключается в одновременном измерении фиксации СО 2 и фотохимических реакций ФСII при различной интенсивности света, в условиях подавляющих фотодыхание . Графики фиксации СО 2 и фотохимических реакций ФСII позволяют вычислить количество электронов, необходимых для ассимиляции одной молекулы СО 2 . Исходя из этой оценки можно оценить уровень фотодыхания . Этот метод используется для исследования значимости фотодыхания в качестве фотозащитного механизма во время засухи.
- Собраду (2008) исследовал газообмен и флуоресценцию хлорофилла в ответ на высокую интенсивность света у пионерных и лесных видов. В полдень производился замер газообмена листьев с измерением общего уровня фотосинтеза и межклеточной концентрации СО 2 ( ). В тех же листьях измерялись параметры флуоресценция хлорофилла (фоновая ; максимум ; и переменная, ). Результаты показали, что, несмотря на то, что пионерные и лесные виды происходят из разных местообитаний, и те и другие показали схожую подверженность полуденному фотоингибированию .
Измерение уровня стресса и стрессоустойчивости
Флуоресценция хлорофилла позволяет измерить уровень стресса растений. По её уровню можно судить об уровне воздействия абиотических стрессов, поскольку экстремальные температуры, избыточное освещение и засуха негативно влияют на метаболизм растений. Это в свою очередь приводит к дисбалансу между поглощением световой энергии хлорофиллом и использованием этой энергии в процессе фотосинтеза .
- Фаваретто и соавт. (2010) исследовали адаптацию к сильному свету у пионерных и поздних сукцессионных видов, выращенных в условиях 100 % (на солнце) и 10 % (в тени) от нормального освещения. Снижение при полном освещении оказалось больше у поздних сукцессионных видов, чем у пионерных видов. В целом эти результаты показывают, что пионерные виды лучше растут при полном освещении, чем позднесукцессионные виды, что предполагает наличие у них высокой толерантности к фотоокислительным повреждениям.
- Неоклеус и Vasilakakis (2009) исследовали реакцию малины на бор и солевой стресс. При помощи флуориметра они замерили , и . Флуоресценция хлорофилла листа незначительно зависела от концентрации NaCl, когда концентрация бора была низкой. Когда концентрацию бора увеличивали, флуоресценция хлорофилла листьев снижалась тех же условиях засоления. Можно сделать вывод, что комбинированное воздействие бора и NaCl на малину вызывает токсический эффект, влияя на фотохимические параметры.
Индекс азотистого баланса

Учитывая связь между содержанием хлорофилла и азота в листьях, содержание хлорофилла можно использовать для обнаружения дефицит азота у растений. Для этого существует несколько разных методов.
Оказалось, что можно судить об азотистом метаболизме растений по уровню полифенолов . Когда растение находится в оптимальных условиях, это способствует нормальному обмену веществ и синтезу белков (основная форма биологического азота), хлорофиллов, и небольшого количества флавоноидов (вторичные метаболиты). С другой стороны, в случае нехватки азота, наблюдается повышенная выработка флавоноидов .
Индекс азотистого баланса позволяет оценить содержание азота в естественных условиях путём расчёта соотношения между хлорофиллом и флавоноидами.
Измерение содержания хлорофилла
Гительзон (1999) постулировал: «Соотношение между флуоресценцией хлорофилла при 735 нм и в диапазоне длин волн от 700 нм до 710 нм, линейно связано с содержанием хлорофилла (с коэффициентом детерминации r2 более чем 0,95) и таким образом может быть использовано как точный показатель содержания хлорофилла в листьях растений.»
Флуориметры

Развитие флуориметров сделало измерение флуоресценции хлорофилла обычным методом в физиологии растений. Революцию в анализе флуоресценции хлорофилла произвело изобретение методики пульс-амплитудной модуляции ( англ. Pulse-Amplitude-Modulation (PAM) ) и появление первого коммерческого импульсного флуориметра или ПАМ-флуориметра PAM-101 (компания Walz, Германия). Путём модуляции амплитуды измеряющего светового пучка (микросекундный диапазон импульсов) и параллельного обнаружения возбуждаемой флуоресценции, можно определить относительный выход флуоресценции (Ft) в присутствии рассеянного света. Принципиально, это означает, что флуоресценция хлорофилла можно измерять в полевых условиях даже под прямыми лучами солнца .
Некоторые импульсные флуориметры могут определить как световые параметры, так и параметры темновая адаптация параметров (F o , F m , F o ', F m ', F v /F m , Y, F t , F oq ) и могут рассчитать коэффициенты тушения фотохимического и нефотохимического тушение (qP, qL, qN, Y(NO), Y(NPQ) и NPQ). Некоторые флуориметры полностью портативны и управляются одной рукой.
Развитие системы визуализации облегчило определение пространственных неоднородностей у фотосинтетически активных образцов. Эти неоднородности возникают в листьях растений, например из-за наростов, различных экологических стрессов или возбудителей инфекций. Знания о неоднородностях образца имеет важное значение для правильной интерпретации результатов измерения фотосинтетической продуктивности образца. Высокие показатели качества изображения обеспечивают возможность анализа одной клетки или даже одного хлоропласта, а также площадей, охватывающих целые листья или растения.
Альтернативные подходы
LIF-сенсоры
Методы, основанные на эффекте Каутского, не исчерпывают всего многообразия методов измерения флуоресценции хлорофилла. В частности, последние достижения в области лазер-индуцированной флуоресценции (LIF) предоставляют возможность для разработки достаточно компактных и эффективных сенсоров для определения фотофизиологического статуса и оценки биомассы. Вместо измерения общего потока флуоресценции такие датчики регистрируют оптическую плотность этого потока, возбуждённого сильным лазерными импульсами наносекундной длительности. Такой метод не требует 15 — 20 мин темновой адаптации (как в случае с методами, основанными на эффекте Каутского ) и даёт возможность возбуждать образец со значительного расстояния. LIF-сенсоры могут обеспечить быструю и оценку с довольно большого расстояния.
См. также
Примечания
- Lu Congming, Zhang Jianhua. (англ.) // Oxford Journals : journal. — 1999. — July. 16 июня 2016 года.
- ↑ (англ.) . Jxb.oxfordjournals.org (1 апреля 2000). Дата обращения: 28 марта 2011. 23 апреля 2012 года.
- ↑ (англ.) . Informaworld.com (3 декабря 2008). Дата обращения: 28 марта 2011.
- Kitajima M., Butler W.L. Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromothymoquinone (англ.) // : journal. — 1975. — Vol. 376 . — P. 105—115 . — doi : .
- Schreiber U., Schliwa U., Bilger W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer (англ.) // Photosynth Res : journal. — Vol. 10 . — P. 51—62 . — doi : .
- Genty B., Briantais J-M, Baker N.R. The relationship betwwen the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence (англ.) // : journal. — 1989. — Vol. 990 . — P. 87—92 . — doi : .
- Sobrado. (англ.) (PDF). (недоступная ссылка)
- (англ.) . Personalpages.manchester.ac.uk. Дата обращения: 6 января 2017. 27 июля 2017 года.
- Favaretto et al. (англ.) : journal. — 2011. 19 сентября 2012 года.
- A. Cartelat, Z.G. Cerovic, Y. Goulas, S. Meyer, C. Lelarge, J.-L. Prioul, A. Barbottin, M.-H. Jeuffroy, P. Gate, G. Agati, I. Moya. (англ.) : journal. — Field Crops Research Volume 91, Issue 1, pages 35-49, 2005. 24 сентября 2015 года.
- Gitelson Anatoly A;Buschmann Claus; Lichtenthaler Hartmut K. (англ.) // Remote Sensing of Environment : journal. — 1999. — Vol. 69 , no. 3 . — P. 296—302 . — doi : .
- Schreiber U., Bilger W.,and Schliwa U. (англ.) // : journal. — Adis International , 1986. — Vol. 10 . — P. 51—62 . — doi : . 21 июля 2017 года.
- Schreiber Ulrich. (англ.) // : journal. — Adis International , 1986. — Vol. 9 . — P. 261—272 . — doi : . 3 июня 2018 года.
- (англ.) . — Norfolk: Hansatech Instruments, 2012. — P. 2. 7 апреля 2016 года. . Дата обращения: 26 марта 2016. Архивировано 7 апреля 2016 года.
Литература
- Lazár. (англ.) // : journal. — 1999. — Vol. 1412 . — P. 1—28 . — doi : .
- Lazár. (англ.) // Functional Plant Biology : journal. — 2006. — Vol. 33 . — P. 9—30 . — doi : .
- Lazár. (англ.) // Plant Physiology : journal. — American Society of Plant Biologists , 2015. — Vol. 175 . — P. 131—147 . — doi : .
- Kalaji et al. (англ.) // : journal. — Adis International , 2012. — Vol. 114 . — P. 69—96 . — doi : .
- Maxwell, K.; Johnson, G.N. (англ.) // Journal of Experimental Botany : journal. — Oxford University Press , 2000. — Vol. 51 , no. 345 . — P. 659—668 . — doi : . — .
- Murchie and Lawson. Chlorophyll fluorescence analysis: a guide to good practice and understanding some new applications (англ.) // Journal of Experimental Botany : journal. — Oxford University Press , 2013. — Vol. 64 , no. 13 . — P. 3983—3998 . — doi : .
- Heinz Walz GmbH. (англ.) .
- 2020-09-05
- 1