Interested Article - Степень окисления

- 2021-12-14
- 1
Сте́пень окисле́ния ( окислительное число ) — вспомогательная условная величина для записи процессов окисления , восстановления и окислительно-восстановительных реакций . Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов : она не является истинным зарядом атома в молекуле (см. ).
Представления о степени окисления элементов положены в основу и используются при классификации химических веществ , описании их свойств, составлении формул соединений и их международных названий ( номенклатуры ). Но особенно широко оно применяется при изучении окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность .
Определение
Степень окисления атома равна численной величине электрического заряда , приписываемого атому в предположении, что электронные пары , осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (то есть исходя из предположения, что соединение состоит только из ионов ). В случае ковалентной связи между одинаковыми атомами электроны делят поровну между атомами.
Степень окисления соответствует числу электронов , которое следует присоединить к положительному иону , чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона , чтобы окислить его до нейтрального атома:
Описание
В научной литературе для обозначения степени окисления элемента используется метод . Степень окисления указывается после названия либо символа элемента римскими цифрами в круглых скобках , причём пробел перед открывающей скобкой не ставится: железо(III), Ni(II).
Степень окисления также может указываться арабскими цифрами сверху над символом элемента: . В отличие от указания заряда иона, при указании степени окисления первым ставится знак , а потом численное значение, а не наоборот (при этом в формулах почти всегда указывается заряд атома/иона, а в тексте — степень окисления +2, +3…, отсюда и путаница; в формулах степень окисления пишут над элементом (знак впереди — на первом месте), заряд для ионов (не для каждого элемента в сложных ионах!) — пишется верхним индексом — сверху справа после иона (знак позади числа): — степени окисления, — заряды.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения, которые обычно ставятся над символом элемента сверху:
Правила вычисления степени окисления:
- Степень окисления атома любого элемента в свободном (несвязанном) состоянии ( простое вещество ) равна нулю , так, например, атомы в молекулах имеют нулевую степень окисления:
- Степень окисления любого простого одноатомного иона соответствует его заряду , например: Na + = +1, Ca 2+ = +2, Cl − = −1.
- Степень окисления водорода в любом неионном соединении равна +1. Это правило применимо к подавляющему большинству соединений водорода , таких, как H 2 O, NH 3 или CH 4 . (Определение через электротрицательность даёт исключение для некоторых веществ: ). Для ионных гидридов металлов, например NaH, степень окисления водорода −1.
- Степень окисления кислорода равна −2 во всех соединениях, где кислород не образует простой ковалентной связи O—O, то есть в подавляющем большинстве соединений — оксидах . Так, степень окисления кислорода равна −2 в H 2 O, H 2 SO 4 , NO, CO 2 и CH 3 OH; но в пероксиде водорода, H 2 O 2 (HO—OH), она равна −1 (другими исключениями из правила, согласно которому кислород имеет степень окисления −2, являются , а также свободные радикалы , например ).
- В соединениях неметаллов , не включающих водород и кислород, неметалл с большей электроотрицательностью считается отрицательно заряжённым. Степень окисления такого неметалла полагается равной заряду его наиболее распространённого отрицательного иона. Например, в CCl 4 степень окисления хлора −1, а углерода +4. В CH 4 степень окисления водорода +1, а углерода −4. В SF 6 степень окисления фтора −1, а серы +6, но в CS 2 степень окисления серы −2, а степень окисления углерода +4.
- Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю:
- Алгебраическая сумма степеней окисления всех атомов в комплексном ионе (катионе либо анионе) должна быть равна его общему заряду (см. также выше 2-й пункт). Так, в ионе NH 4 + степень окисления N должна быть равной −3 и, следовательно, −3 + 4 = +1. Поскольку в ионе SO 4 2− сумма степеней окисления четырёх атомов кислорода равна −8, сера должна иметь степень окисления, равную +6, чтобы полный заряд иона оказался равным −2.
- В химических реакциях должно выполняться правило сохранения алгебраической суммы степеней окисления всех атомов . Именно это правило делает понятие степени окисления столь важным в современной химии. Если в ходе химической реакции степень окисления атома повышается, говорят, что он окисляется , если же степень окисления атома понижается, говорят, что он восстанавливается . В полном уравнении химической реакции окислительные и восстановительные процессы должны точно компенсировать друг друга .
-
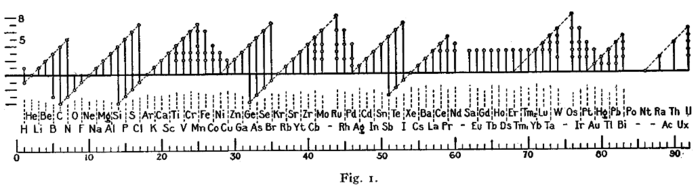
Максимальная положительная степень окисления элемента обычно численно совпадает с номером его
группы
в
периодической системе
(
классического короткого варианта таблицы
). Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления минус восемь (например, для
халькогена
S
положительная степень окисления +6, макс. отрицательная 6 − 8 = −2).
Исключение составляют фтор , кислород , благородные газы (кроме ксенона ), а также железо , кобальт , родий и элементы подгруппы никеля : их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. Иридий имеет высшую степень окисления +9 . У элементов подгруппы меди , наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе. У лантаноидов степени окисления не превышают +4 (в особых условиях зафиксирована степень окисления +5 для празеодима ); у актиноидов зафиксированы степени окисления вплоть до +7.
Правило о равенстве числу восемь суммы абсолютных величин степеней окисления элемента (R) по кислороду (RO) и по водороду (HR; то есть положительных и отрицательных степеней окисления) соблюдается лишь для p-элементов IV—V—VI—VII групп таблицы ПСХЭ . - Элементы- металлы в соединениях обычно имеют положительную степень окисления. Однако встречаются соединения, где степень окисления металлов нулевая (нейтральные карбонилы и некоторые другие комплексы) и отрицательная ( алкалиды , ауриды , анионные карбонилы , ) .
Понятие степени окисления вполне применимо и для нестехиометрических соединений (КС 8 , Mo 5 Si 3 , Nb 3 B 4 и др.).
Условность
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью . Например, в органических соединениях углерод всегда четырёхвалентен, а степень окисления атома углерода в соединениях метана CH 4 , метилового спирта CH 3 OH, формальдегида HCOH, муравьиной кислоты HCOOH и диоксида углерода CO 2 , соответственно, равна −4, −2, 0, +2 и +4.
Степень окисления зачастую не совпадает с фактическим числом электронов , которые участвуют в . Обычно это молекулы с различными электрондефицитными химическими связями и делокализацией электронной плотности . Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как ковалентность равна 4, а координационное число — 3. В молекуле озона , имеющей сходное с SO 2 строение, атомы кислорода характеризуется нулевой степенью окисления (хотя часто говорят, что центральный атом кислорода имеет степень окисления +4).
Степень окисления в большинстве случаев не отражает также действительный характер и степень электрической поляризации атомов (истинного заряда атомов, определённых экспериментальным путём). Так, и в HCl, и в NaCl степень окисления
хлора
принимается равной −1, тогда как на самом деле поляризация его атома (относительный
эффективный заряд
δ
−
) в этих соединениях различна:
δ
Cl
(HCl) = −0,17 единицы заряда,
δ
Cl
(NaCl) = −0,9 единицы заряда (абсолютного
заряда электрона
);
водорода
и
натрия
— соответственно +0,17 и +0,90
.
А в кристаллах
сульфида цинка
ZnS заряды атомов
цинка
и
серы
равны соответственно +0,86 и −0,86, вместо степеней окисления +2 и −2
.
На примере хлорида аммония удобно затронуть существующее в современной химии перекрещивание различных понятий. Так, в NH 4 Cl атом азота имеет степень окисления −3, ковалентность IV, электровалентность (формальный заряд по Льюису) +1 { аммоний -катион имеет заряд также 1+}, и общую валентность (структурную; общее координационное число ) 5, а для его эффективного заряда предлагалось значение −0,45 .
Проблемы
Применение понятия степени окисления проблематично для следующих классов соединений :
- Соединения, содержащие ковалентные связи между атомами близкой электроотрицательности , например: PH 3 , Cl 3 N. В этом случае использование различных шкал электроотрицательности даёт различные результаты. В 2014 году ИЮПАК дал рекомендацию пользоваться шкалой электроотрицательности Аллена, поскольку другие шкалы используют понятия валентного состояния атома (что усложняет определение условной величины) или его степени окисления (что создаёт порочный круг) .
- Соединения, содержащие делокализованные ковалентные связи и являющиеся промежуточными между резонансными структурами, где степени окисления атомов различны. Например, в молекуле N 2 O крайний атом азота имеет степень окисления от −1 до 0, средний — от +2 до +3. В случае, когда атомы одного элемента в структуре равноправны, им приписывают среднее из возможных значений степени окисления, которое может быть дробным. Например: . В уравнениях окислительно-восстановительных реакций часто используют средние (в том числе дробные) значения степени окисления даже в том случае, когда атомы неравноправны, например (по строгому определению ).
- Соединения, содержащие полностью делокализованные электроны ( металлическая связь ). Например, дикарбид лантана LaC 2 состоит из ионов La 3+ , C 2 2− и делокализованных электронов. Наличие в соединении ионов C 2 2− позволяет считать степень окисления лантана равной +2; с другой стороны, бо́льшая длина связи C≡C по сравнению с CaC 2 , объясняемая взаимодействием делокализованных электронов с антисвязывающими орбиталями, позволяет считать степень окисленния углерода равной −3/2. Третья возможность — рассматривать такие соединения как электриды , то есть не приписывать делокализованные электроны ни одному из атомов. В случае, когда все элементы в соединении — металлы (см. Интерметаллиды ), их степени окисления обычно считают равными нулю.
Пример составления уравнения окислительно-восстановительной реакции
Составляем электронные уравнения:
Найденные коэффициенты проставляем в схему процесса, заменяя стрелку на знак равенства:
(то есть в
электронных реакциях (методе электронного баланса)
железо с дробной степенью окисления записывается только с коэффициентом 3).
На самом деле, в растворе нет ионов Fe
2+
, Fe
3+
(и уж тем более Fe
+8/3
), также как и Cr
6+
, Mn
7+
, S
6+
, а есть ионы CrO
4
2−
, MnO
4
−
, SO
4
2−
, а равно и
малодиссоциированные «электролиты»
Fe
3
O
4
(FeO•Fe
2
O
3
). Именно поэтому следует отдать предпочтение методу
полуреакций
(ионно-электронным методам)
и применять его при составлении уравнении всех окислительно-восстановительных реакций, протекающих в водных растворах. То есть мы можем воспользоваться готовой реакцией
стандартного электродного потенциала
:
Fe
3
O
4
+ 8H
+
+ 8e
−
= 3Fe + 4H
2
O,
E°
= −0,085 В.
См. также
Примечания
- Окислительное число // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров . — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Справочник химика. Под ред. Б. П. Никольского, Л: Химия, 1971. С. 13.
- Эту фиктивную зарядность в молекулах с ковалентными связями правильнее называть степенью окисления элемента, иначе, его окислительным числом . Для отличия от положительной или отрицательной зарядности (например, , ) знаки при степени окисления (окислительном числе) меняют на обратные (например, ). Адекватны этой формуле и изображения: H→F и H δ+ —F δ− . Агафошин Н.П . Периодический закон и периодическая система хим. элементов Д. И. Менделеева. — 2-е изд. — М.: Просвещение, 1982. — с. 56
- Guanjun Wang, Mingfei Zhou, James T. Goettel, Gary J. Schrobilgen, Jing Su, Jun Li, Tobias Schlöder, Sebastian Riedel. Identification of an iridium-containing compound with a formal oxidation state of IX (англ.) // Nature. — 2014. — Vol. 514. — P. 575—577. — doi : .
- Qingnan Zhang, Shu‐Xian Hu, Hui Qu, Jing Su, Guanjun Wang, Jun‐Bo Lu, Mohua Chen, Mingfei Zhou, Jun Li. Pentavalent Lanthanide Compounds: Formation and Characterization of Praseodymium(V) Oxides (англ.) // Angewandte Chemie International Edition. — 2016. — Vol. 55. — P. 6896–6900. — ISSN . — doi : .
- John E. Ellis. Adventures with Substances Containing Metals in Negative Oxidation States (англ.) // Inorganic Chemistry. — 2006. — Vol. 45. — P. 3167—3186. — doi : .
- (нем.) . Дата обращения: 14 марта 2015. 29 марта 2015 года.
-
Степень окисления не следует путать с истинным
эффективным зарядом
атома, который практически всегда выражается дробным числом.
Рассмотрим для наглядности ряд соединений хлора:
В HCl хлор отрицательно одновалентен. В молекуле Cl 2 , к примеру, ни один из атомов не оттягивает электронов больше другого, следовательно, заряд [а равно и степень окисления ] равен нулю. В Cl 2 O хлор снова одновалентен, но уже положительно. В Cl 2 O 7 хлор положительно семивалентен:
Определяемые подобным образом электрохимические валентности (степени окисления) отдельных атомов могут не совпадать с их обычными (структурными) валентностями. Например, в молекуле Cl 2 (Cl-Cl) каждый атом хлора электрохимически нуль-валентен (точнее, степень окисления = 0), но структурно он одновалентен ( валентность = I).
Некрасов Б.В . Основы общей химии. — 3-е изд., испр. и доп. — М.: Химия, 1973. — Т. I. — стр. 285—295
см. также Эффективный заряд . - Угай Я. А. от 13 апреля 2014 на Wayback Machine // Соросовский образовательный журнал . — 1997. — № 3. — С. 53-57
- Некрасов Б.В . Основы общей химии. — 3-е изд., испр. и доп. — М.: Химия, 1973. — Т. I. — стр. 395
- Pavel Karen, Patrick McArdle, Josef Takats. Toward a comprehensive definition of oxidation state (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2014. — Vol. 86, no. 6 . — P. 1017—1081. — ISSN . — doi : .
- P. Karen, P. McArdle, J. Takats. (англ.) // Pure Appl. Chem.. — 2015. — 16 December. 2 февраля 2017 года.
- 2021-12-14
- 1