Interested Article - Каботегравир

- 2020-12-11
- 2
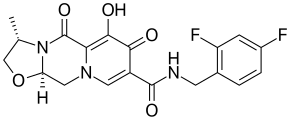
Каботегравир (торговая марка Vocabria ) — лекарство , используемое для лечения ВИЧ/СПИДа у взрослых. Он доступен в форме таблеток и в виде внутримышечной инъекции , а также в виде инъекционной комбинации с рилпивирином под торговой маркой Cabenuva. Лекарственные формы для инъекций применяются один раз в месяц или один раз в два месяца .
Это ингибитор интегразы со структурой карбамоилпиридона, аналогичной структуре долутегравира .
Медицинское использование
Каботегравир в комбинации с рилпивирином показан для лечения ВИЧ-1 у взрослых. Таблетки используются для проверки переносимости пациентом лечения до начала инъекционной терапии . Эти два препарата являются первыми антиретровирусными препаратами в форме инъекций длительного действия. Это означает, что вместо ежедневных таблеток люди получают внутримышечные инъекции ежемесячно или каждые два месяца .
Противопоказания и взаимодействия
Каботегравир нельзя сочетать со следующими препаратами: рифампицин , рифапентин , карбамазепин , окскарбазепин , фенитоин или фенобарбитал , которые индуцируют фермент UGT1A1 . Эти препараты значительно снижают концентрацию каботегравира в организме и, таким образом, могут снизить его эффективность . Кроме того, они индуцируют фермент CYP3A4 , что приводит к снижению концентрации рилпивирина в организме .
Побочные эффекты
Наиболее частыми побочными эффектами инъекционной комбинированной терапии с рилпивирином являются реакции в месте инъекции (у 84% пациентов), такие как боль и отек , а также головная боль (до 12%) и лихорадка или ощущение жара (у 10% пациентов). Что касается таблеток, то головная боль и чувство жара наблюдались несколько реже. Менее распространенными побочными эффектами (менее 10%) для обоих препаратов являются депрессивные расстройства , бессонница и сыпь .
Фармакология
Механизм действия
Каботегравир – ингибитор переноса цепи интегразы. Это означает, что он блокирует фермент интегразу вируса HI, тем самым предотвращая интеграцию его генома в ДНК клеток человека. Поскольку это необходимый шаг для репликации вируса , его дальнейшее распространение затруднено .
Фармакокинетика

При приеме внутрь каботегравир достигает наивысшего уровня в плазме крови через три часа. Прием препарата вместе с пищей незначительно увеличивает его концентрацию в крови, но это не имеет клинического значения. После инъекции в мышцу каботегравир медленно всасывается в кровоток, достигая наивысшего уровня в плазме крови примерно через семь дней .
Более 99% вещества связывается с белками плазмы . Препарат инактивируется в организме путем глюкуронизации, главным образом ферментом UGT1A1 и в гораздо меньшей степени UGT1A9. Однако более 90% циркулирующего вещества составляет неизмененный каботегравир. Биологический период полувыведения составляет 41 час для таблеток и от 5.6 до 11.5 недель для инъекций .
Выведение изучается только при пероральном приеме : большая часть препарата выводится с фекалиями в неизмененном виде (47%). Неизвестно, сколько из этого количества поступает с желчью, а какое не абсорбировалось изначально (На самом деле желчь содержит глюкуронид, но он может снова расщепляться в просвете кишечника, чтобы дать исходное вещество, которое наблюдается в фекалиях). В меньшей степени он выводится с мочой (27%), почти исключительно в виде глюкуронида .
Фармакогеномика
У слабых метаболизаторов UGT1A1 концентрация каботегравира в организме увеличивается в 1,3–1,5 раза. Это не считается клинически значимым .
Химия
Каботегравир представляет собой кристаллический порошок от белого до почти белого цвета, который практически нерастворим в водных растворах при pH 9 и мало растворим при более высоких значениях pH 10. Каботегравир слабокислый с p K a 7,7 для еноловой кислоты и 1,1 (подсчитано) для карбоксамида . В молекуле два асимметричных атома углерода; в лекарстве присутствует только одна из четырех возможных конфигураций .
Формулировка
В исследованиях вещество упаковано в наночастицы (GSK744LAP), обеспечивающие биологический период полураспада от 21 до 50 дней после однократной дозы. Продаваемый препарат для инъекций достигает своего длительного периода полужизни не за счет наночастиц, а за счет суспензии свободной кислоты каботегравира. Таблетки содержат натриевую соль каботегравира .
История
Каботегравир был исследован в клинических испытаниях HPTN 083 и HPTN 084 . В 2020 году «Комитет по лекарственным препаратам для человека» (CHMP) Европейского агентства лекарственных средств (EMA) принял положительное заключение, рекомендуя предоставить разрешение на продажу лекарственного препарата Vocabria, предназначенного для лечения инфекции ВИЧ-1 в сочетании с инъекцией рилпивирина The EMA also recommended marketing authorization be given for rilpivirine and cabotegravir injections to be used together for the treatment of people with HIV-1 infection. . EMA также рекомендовало выдать разрешение на продажу инъекций рилпивирина и каботегравира для совместного использования для лечения людей с ВИЧ-1-инфекцией .
Общество и культура
Имена
Каботегравир – это название, принятое в США (USAN) , и международное непатентованное название (INN) .
Исследования
Предэкспозиционная профилактика
В 2020 году были опубликованы результаты некоторых исследований, которые показали успех использования инъекционного каботегравира для пролонгированной предэкспозиционной профилактики (ПрЭП) с большей эффективностью, чем комбинация , широко применяемая в то время для ПрЭП .
Примечания
- (неопр.) U.S. Food and Drug Administration (FDA) (Press release) (21 января 2021). Дата обращения: 10 апреля 2021. 21 января 2021 года.
- ↑ (неопр.) . European Medicines Agency. Дата обращения: 10 апреля 2021. 10 апреля 2021 года.
- .
- ↑ (неопр.) . European Medicines Agency (EMA) (16 октября 2020). Дата обращения: 10 апреля 2021. 17 октября 2020 года.
- (неопр.) . Дата обращения: 10 апреля 2021. 10 апреля 2021 года.
- Rilpivirine от 10 апреля 2021 на Wayback Machine . 2021-04-10.
- Patel, Mitesh; Eberl, H. Christian; Wolf, Andrea; Pierre, Esaie; Polli, Joseph W.; Zamek-Gliszczynski, Maciej J. (2019). " ". Journal of Pharmacology and Experimental Therapeutics . 370 (2): 269–277. doi : от 10 апреля 2021 на Wayback Machine . PMID от 10 апреля 2021 на Wayback Machine . S2CID от 10 апреля 2021 на Wayback Machine .
- ↑ (неопр.) . European Medicines Agency (15 октября 2020). Дата обращения: 10 апреля 2021. 10 апреля 2021 года.
- (неопр.) . HIV Prevention Trials Network (7 июля 2020). Дата обращения: 10 апреля 2021. 27 июля 2018 года.
- (неопр.) . HIV Prevention Trials Network (9 ноября 2020). Дата обращения: 10 апреля 2021. 27 июля 2018 года.
- (неопр.) . European Medicines Agency (EMA) (16 октября 2020). Дата обращения: 16 октября 2020. 1 января 2021 года. Текст был скопирован из этого источника © European Medicines Agency. Воспроизведение разрешено при условии указания источника.
- European Medicines Agency (EMA) (16 October 2020). . Пресс-релиз . из первоисточника 17 октября 2020. Проверено 2021-04-10 .
- (неопр.) . American Medical Association . Дата обращения: 19 сентября 2014.
- World Health Organization (2015). “International nonproprietary names for pharmaceutical substances (INN): recommended INN: list 73”. WHO Drug Information . 29 (1): 70–1. : .
- Ryan, Benjamin . , (7 июля 2020). 13 июня 2021 года. Дата обращения: 9 ноября 2020.
- Ryan, Benjamin . , (9 ноября 2020). 8 мая 2021 года. Дата обращения: 9 ноября 2020.
Литература
- Borrell, Brendan. // Nature. — 2014. — doi : .
- 2020-12-11
- 2