Interested Article - Метиллитий

- 2021-02-19
- 1
Метиллитий — металлоорганическое соединение лития с формулой LiCH 3 , бесцветные кристаллы, растворимые в органических растворителях, существует в виде тетра- и гексамеров.
Получение
- Реакция лития и бромистого метила :
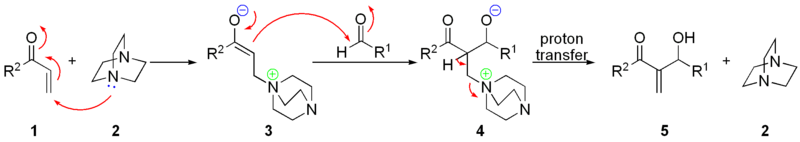
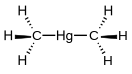
- Реакция этиллития и диметилртути :
Физические свойства
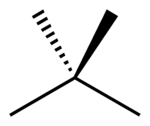
Метиллитий образует в полярных растворителях (эфиры, тетрагидрофуран ) и в кристалле тетрамерную форму (LiCH 3 ) 4 — искажённый куб.
В неполярных растворителях ( бензол , углеводороды ) — гексамеры (LiCH 3 ) 6 .
Химические свойства
- Разлагается при нагревании:
- В чистом виде окисляется кислородом воздуха (с самовоспламенением), поэтому работают с метиллитием в эфирных растворах.
- Бурно реагирует с водой:
Применение
- В органическом синтезе.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М. : Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5 .
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М. : Мир, 1971. — Т. 1. — 561 с.
- 2021-02-19
- 1