Interested Article - Уравнение состояния

- 2020-02-11
- 1
Уравне́ние состоя́ния — соотношение, отражающее для конкретного класса термодинамических систем связь между характеризующими её макроскопическими физическими величинами , такими как температура , давление , объём , химический потенциал , энтропия , внутренняя энергия , энтальпия и др. Уравнения состояния необходимы для получения с помощью математического аппарата термодинамики конкретных результатов, касающихся рассматриваемой системы . Эти уравнения не содержатся в постулатах термодинамики, так что для каждого выбранного для изучения макроскопического объекта их либо определяют эмпирически, либо для модели изучаемой системы находят методами статистической физики . В рамках термодинамики уравнения состояния считают заданными при определении системы . Если изучаемый объект допускает термодинамическое описание, то это описание выполняют посредством уравнений состояния, которые для реальных веществ могут иметь весьма сложный вид.
О терминологии
Из множества уравнений состояния выделяются:
- уравнения состояния, выражающие интенсивные переменные состояния , входящие в фундаментальное уравнение Гиббса в энергетическом выражении и фундаментальное уравнение Гиббса энтропийном выражении , в виде функций от экстенсивных переменных состояния — аргументов соответствующего фундаментального уравнения Гиббса (см. примечание );
- термические уравнения состояния , выражающие связь между температурой, обобщёнными термодинамическими координатами (к которым в данном случае причислены количества составляющих систему веществ ) и обобщёнными термодинамическими силами (к которым в данном случае причислены химические потенциалы составляющих систему веществ ) . Обычно под уравнениями состояния, если специально не оговаривается, подразумевают термические уравнения состояния . Величины, входящие термическое уравнение состояния, именуют первичными термическими величинам ;
- калорические уравнения состояния , отражающие связь между первичными калорическими величинами и первичными термическими величинами. В качестве первичных калорических величин обычно выступают термодинамические потенциалы (чаще всего внутренняя энергия и энтальпия ) и энтропия как родоначальница ряда функций Массье — Планка ;
- канонические уравнения состояния (фундаментальные уравнения Гиббса для термодинамических потенциалов), представляющие собой выражения для термодинамических потенциалов как функций их естественных независимых переменных .

В русскоязычной учебной литературе получила распространение более узкая трактовка понятий «термические уравнения состояния» и «калорическое уравнение состояния», позволяющая за счёт потери общности заметно упростить изложение рассматриваемого вопроса. А именно, в узком смысле под термическим уравнением состояния понимают зависимость обобщённой силы или химического потенциала от температуры , обобщённых координат и масс составляющих веществ :
(выражение есть сокращение для перечисления переменных определённого типа, в данном случае — обобщённых координат). В узком смысле под калорическим уравнением состояния понимают зависимость от температуры и других первичных термических величин внутренней энергии :
или энтальпии .
Общее число уравнений состояния (все термические плюс калорическое) термодинамической системы при таком подходе равно числу термодинамических степеней свободы системы, то есть числу независимых переменных, характеризующих состояние системы, а их полный набор необходим и достаточен для исчерпывающего описания термодинамических свойств системы .
Далее — если иное не оговорено особо — для большей наглядности речь будет идти об однородных закрытых термодеформационных системах в статическом (локальноравновесном) состоянии . Вариантность такой системы равна двум (см. Правило Дюгема ) и для её полного описания — помимо калорического уравнения состояния — требуется единственное термическое уравнение состояния. Простейшим примером такой системы служит газ в цилиндре с поршнем.
Термическое уравнение состояния
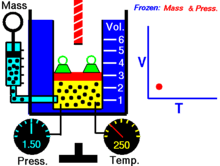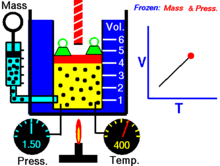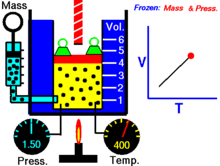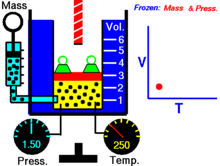
Термическое уравнение состояния (ТУС, термин введён Х. Камерлинг-Оннесом ) для закрытой термодеформационной системы связывает между собой её давление, объём и температуру; его общий вид можно записать так :
| (Термическое уравнение состояния, заданное как неявная функция) |
Или же так:
| (Термическое уравнение состояния, заданное как иная неявная функция) |
Таким образом, чтобы задать термическое уравнение состояния необходимо конкретизировать вид функции .
Для идеального газа (как классического, так и квазиклассического) его термическое уравнение состояния известно как уравнение Клапейрона (уравнение Клапейрона — Менделеева) :
где — универсальная газовая постоянная , — масса газа, — его молярная масса .
Для фотонного газа его давление зависит только от температуры, а термическое уравнение состояния выглядит так :
| (Термическое уравнение состояния фотонного газа) |
где a — радиационная постоянная .
Для макроскопических объектов, требующих от термодинамики учёта их магнитных и электрических свойств, термические уравнения состояния имеют следующий вид :
| (Термическое уравнение состояния магнетика) |
| (Термическое уравнение состояния электрически поляризуемой среды) |
где — намагниченность вещества, — напряжённость магнитного поля , — поляризованность вещества, — напряжённость электрического поля .
Для упругого стержня (из изотропного материала) длиной L , на который действует сила F , направленная вдоль стержня, термическое уравнение состояния выглядит так :
| (Термическое уравнение состояния упругого стержня) |
Термические коэффициенты
Выражая одну из переменных в через две другие, для простой закрытой системы в зависимости от выбора независимых переменных термическое уравнение состояния можно записать тремя способами :
| (Термическое уравнение состояния с независимыми переменными T и V ) |
| (Термическое уравнение состояния с независимыми переменными T и P ) |
| (Термическое уравнение состояния с независимыми переменными V и P ) |
Запишем эти уравнения в дифференциальной форме :
| (Дифференциальное ТУС с независимыми переменными T и V ) |
| (Дифференциальное ТУС с независимыми переменными T и P ) |
| (Дифференциальное ТУС с независимыми переменными P и V ) |
В приведённые уравнения входят шесть частных производных, которые попарно обратны друг другу:
поэтому самостоятельное значение имеют только три из них. В качестве основных обычно выбирают производные
- и
которые называют термическими коэффициентами . Название отражает связь этих коэффициентов с термическим уравнением состояния.
Из математического анализа известно, что для любой неявно заданной функции трёх переменных
справедливо соотношение
| (Термическое уравнение состояния в дифференциальной форме) |
или
то есть любой из трёх термических коэффициентов можно выразить через два других. Это соотношение иногда называют термическим уравнением состояния в дифференциальной форме .
На практике используют не сами частные производные, а образованные из них коэффициенты (также называемые термическими коэффициентами , либо же термодинамическими коэффициентами ):
изобарный коэффициент термического расширения
| (Изобарный коэффициент объёмного расширения; коэффициент термического расширения; температурный коэффициент всестороннего расширения; термический коэффициент всестороннего расширения) |
характеризующий скорость изменения объёма при изменении температуры в условиях постоянного давления (для идеального газа );
термический коэффициент давления при постоянном объёме
| (Изохорный коэффициент давления; температурный коэффициент давления; термический коэффициент давления; коэффициент термической упругости) |
характеризующий скорость изменения давления при изменении температуры в условиях постоянного объёма (для идеального газа );
изотермический коэффициент всестороннего сжатия
| (Изотермический коэффициент всестороннего сжатия; коэффициент изотермического сжатия; коэффициент объёмного сжатия; коэффициент сжимаемости; коэффициент объёмной упругости; коэффициент объёмного упругого расширения) |
характеризующий скорость изменения объёма при изменении давления в условиях постоянной температуры (для идеального газа ). Знак минус указывает на уменьшение объёма с повышением давления и нужен для того, чтобы избежать отрицательных значений коэффициента сжимаемости .
Из вытекает уравнение связи между коэффициентами объёмного расширения, упругости и сжатия :
| (Уравнение связи между коэффициентами объёмного расширения, упругости и сжатия) |
Это соотношение позволяет, например, найти коэффициент для твёрдых и жидких тел (которые практически невозможно нагреть или охладить без изменения их объёма) по определяемым опытным путём коэффициентам и .
Термические коэффициенты являются функциями объёма, давления и температуры. Практическое значение коэффициентов объёмного расширения, упругости и сжатия состоит в том, что они используются для вычисления тех термодинамических величин, которые затруднительно или невозможно определить экспериментально.
Калорическое уравнение состояния
Если в в качестве обязательной переменной (зависимой или независимой) входит температура, то калорическое уравнение состояния (КУС) для простой закрытой системы отражает зависимость внутренней энергии от термодинамических параметров состояния (температуры и объёма, температуры и давления, объёма и давления) (авторство термина КУС принадлежит Х. Камерлинг-Оннесу ) :
| (Калорическое уравнение состояния с независимыми переменными T и V ) |
| (Калорическое уравнение состояния с независимыми переменными T и P ) |
| (Калорическое уравнение состояния с независимыми переменными V и P ) |
Калорические коэффициенты
Калорические коэффициенты вводят способом, аналогичным способу введения термических коэффициентов. Запишем с независимыми переменными и в дифференциальной форме :
| (Дифференциальное КУС с независимыми переменными и ) |
и посредством входящих в это соотношение частных производных введём первую пару калорических коэффициентов — теплоёмкость при постоянном объёме
| (Теплоёмкость при постоянном объёме) |
и теплоту изотермического расширения
| (Теплота изотермического расширения) |
имеющую размерность давления. Применявшееся ранее для этого калорического коэффициента название скрытая теплота расширения как пережиток теории теплорода к использованию не рекомендуется .
Для идеального газа теплоёмкость при постоянном объёме равна : для одноатомных, для двухатомных и для многоатомных газов. Здесь — масса газа, — молярная масса этого газа, — универсальная газовая постоянная . Теплота изотермического расширения идеального газа .
Частная производная
| (Внутреннее давление) |
носит название внутреннего давления и к калорическим коэффициентам не относится, хотя и вводится одновременно с ними. Численное значение этой величины (отражающей на молекулярном уровне взаимное притяжение частиц), мало для реальных газов и очень велико (по сравнению с обычными значениями внешнего давления) для жидкостей и твёрдых тел . Для идеального газа то есть внутренняя энергия идеального газа не зависит от объёма (закон Джоуля ) .
Введём вторую пару калорических коэффициентов, связанных с с независимыми переменными и — теплоёмкость при постоянном давлении
| (Теплоёмкость при постоянном давлении, выраженная через внутреннюю энергию) |
и теплоту изотермического возрастания давления
| (Теплота изотермического возрастания давления, выраженная через внутреннюю энергию) |
В литературе эти калорические коэффициенты чаще приводят в более компактном и удобном для расчётов виде, используя энтальпию или энтропию :
| (Теплоёмкость при постоянном давлении, выраженная через энтальпию) |
| (Теплота изотермического возрастания давления; теплота изотермического сжатия) |
Для идеального газа и связаны . Коэффициент в подавляющем большинстве случаев есть величина отрицательная; для идеального газа . Применявшееся ранее для этого калорического коэффициента название скрытая теплота изменения давления к использованию не рекомендуется.
Приведём определения для последней пары калорических коэффициентов, связанных с с независимыми переменными и — теплоты изохорного сжатия
| (Теплота изохорного сжатия) |
и теплоты изобарного расширения
| (Теплота изобарного расширения) |
Четыре из шести введённых калорических коэффициентов ( и ), имея самостоятельный физический смысл, являются полезными вспомогательными величинами при выводе термодинамических соотношений и в термодинамических расчётах, в частности, при вычислении внутренней энергии, энтальпии и энтропии. Коэффициенты и в настоящее время вышли из употребления .
Связь между термическими и калорическими коэффициентами
Полезные соотношения, связывающие термические и калорические коэффициенты :
| (Уравнение связи между термическим и калорическим уравнениями состояния) |
| (Теорема Реша, 1854 ) |
Для идеального газа
| (Формула Майера ) |
Каноническое уравнение состояния
Основная статья: Термодинамические потенциалы .
Каноническое уравнение представляет собой выражение для одного из термодинамических потенциалов ( внутренней энергии , энтальпии , свободной энергии или потенциала Гиббса ) через независимые переменные, относительно которых записывается его полный дифференциал.
- (для внутренней энергии),
- (для энтальпии),
- (для энергии Гельмгольца),
- (для потенциала Гиббса).
Каноническое уравнение, независимо от того, в каком из этих четырёх видов оно представлено, содержит полную информацию о термических и калорических свойствах термодинамической системы (предполагается, что известно и определение термодинамического потенциала, такое, как F = U − TS ).
Уравнения состояния газов
К уравнениям состояния газов относятся:
- Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона)
- Уравнение Ван-дер-Ваальса (уравнение состояния реального газа)
- Уравнение Дитеричи
- Уравнение состояния Редлиха — Квонга
- Уравнение состояния Барнера — Адлера
- Уравнение состояния Суги — Лю
- Уравнение состояния Ли — Эрбара — Эдмистера
Уравнения состояния жидкостей
- Уравнение состояния Бенедикта — Вебба — Рубина
- Модели локального состава ( Модель Вильсона , NRTL , , , )
Уравнения состояния твёрдых тел
Состояние твёрдых тел можно описать с помощью уравнения Ми — Грюнайзена
См. также
Примечания
- ↑ , с. 39—40 .
- ↑ , с. 136—137.
- ↑ , с. 30.
- , с. 24—25.
- , p. 69.
- , с. 92.
-
Запишем
фундаментальное уравнение Гиббса в энергетическом выражении
для однородной термодинамической системы:
(Фундаментальное уравнение Гиббса в энергетическом выражении) где — экстенсивные величины ( термодинамические координаты состояния ). Сопряжённые с ними интенсивные величины ( термодинамические потенциалы взаимодействия ) есть
(Термодинамический потенциал взаимодействия) Любое из соотношений
(Уравнение состояния) представляет собой уравнение состояния. Уравнения состояния не являются независимыми друг от друга, так как входящие в них интенсивные величины связаны соотношением, дифференциальная форма которого называется уравнением Гиббса — Дюгема :
(Уравнение Гиббса — Дюгема) Для однокомпонентной термодинамической фазы имеем ( — внутренняя энергия , — температура , — энтропия , — давление , — объём , — химический потенциал компонента , — масса компонента):
энергетическое выражение фундаментального уравнения Гиббса в интегральной форме- ;
энергетическое выражение фундаментального уравнения Гиббса в дифференциальной форме
- ;
уравнения состояния
- ;
- ;
- ;
уравнение Гиббса — Дюгема
- .
- , p. 72.
- , с. 96.
- ↑ , с. .
- ↑ , с. 12.
- ↑ , с. 248.
- , с. 17.
- ↑ , с. 12.
- ↑ , с. 111.
- , с. 176.
- , с. 13.
- , с. 112.
- ↑ , с. 34.
- , с. 158.
- ↑ , с. 32.
- , с. 65.
- , с. 41.
- , с. 166.
- , с. 212.
- , с. .
- , с. 308.
- , с. 225.
- Состояние простой термодинамической системы (газы и изотропные жидкости в ситуации, когда поверхностными эффектами и наличием внешних силовых полей можно пренебречь) полностью задано её объёмом, давлением в системе и массами составляющих систему веществ.
- , с. 15–16, 86.
- ↑ , с. 86–87.
- , с. 63.
- ↑ , с. 88.
- ↑ , с. 10.
- , с. 36.
- ↑ , с. 40.
- ↑ , с. 28.
- , с. 24.
- , с. 87–88.
- ↑ , с. 38.
- , с. 110.
- , с. 108.
- , с. 33.
- ↑ , с. 109.
- , с. 18.
- , с. 295.
- , с. 44.
- , с. 47.
- , с. 31.
- , с. 18.
- , с. 30.
- ↑ , с. 39.
- ↑ , с. 38.
- , с. 25.
- ↑ , с. 41.
- , с. 42.
- , с. 146.
- ↑ , с. 65.
- ↑ , с. 48.
- , с. 27, 58–60.
- , с. 60.
- , с. 27.
- , с. 40, 114, 146.
- , с. 41.
- , с. 41.
- , с. 83, 95.
Литература
- Münster A. Classical Thermodynamics. — London e. a.: Wiley-Interscience, 1970. — xiv + 387 p. — ISBN 0 471 62430 6 .
- Александров А. А. Термодинамические основы циклов теплоэнергетических установок. — М. : Издательский дом МЭИ, 2016. — 159 с. — ISBN 978-5-383-00961-1 .
- Базаров И. П. Заблуждения и ошибки в термодинамике. — 2-е изд., испр. — М. : Едиториал УРСС, 2003. — 120 с. — ISBN 5-354-00391-1 .
- Базаров И. П. (недоступная ссылка) . — М.: Высшая школа, 1991. — 376 с.
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.— Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3 .
- Барилович B. A., Смирнов Ю. А. Основы технической термодинамики и теории тепло- и массообмена. — М. : ИНФРА-М, 2014. — 432 с. — (Высшее образование: Бакалавриат). — ISBN 978-5-16-005771-2 .
- Бахшиева Л. Т. и др. Техническая термодинамика и теплотехника / Под ред. проф А. А. Захаровой. — 2-е изд., испр. — М. : Академия, 2008. — 272 с. — (Высшее профессиональное образование). — ISBN 978-5-7695-4999-1 .
- Белов Г. В. Термодинамика. Часть 1. — 2-е изд., испр. и доп. — М. : Юрайт, 2017. — 265 с. — (Бакалавр. Академический курс). — ISBN 978-5-534-02731-0 .
- Белоконь Н. И. Основные принципы термодинамики. — М. : Недра, 1968. — 112 с.
- Бурдаков В. П., Дзюбенко Б. В., Меснянкин С. Ю., Михайлова Т. В. Термодинамика. Часть 1. Основной курс. — М. : Дрофа, 2009. — 480 с. — (Высшее образование. Современный учебник). — ISBN 978-5-358-06031-9 .
- Бурдаков В. П., Дзюбенко Б. В., Меснянкин С. Ю., Михайлова Т. В. Термодинамика. Часть 2. Специальный курс. — М. : Дрофа, 2009. — 362 с. — (Высшее образование. Современный учебник). — ISBN 978-5-358-06140-8 .
- Бурсиан В. Р. , Соколов П. Т. Лекции по термодинамике. — Л. : Кубуч, 1934. — 352 с.
- Василевский А. С. Термодинамика и статистическая физика. — 2-е изд., перераб.. — М. : Дрофа, 2006. — 240 с. — ISBN 5-7107-9408-2 .
- Герасимов Я. И., Древинг В. П., Еремин Е. Н. и др. Курс физической химии / Под общ. ред. Я. И. Герасимова. — 2-е изд. — М. : Химия, 1970. — Т. I. — 592 с.
- Глазов В. М. Основы физической химии. — М. : Высшая школа, 1981. — 456 с.
- Гуйго Э. И., Данилова Г. Н., Филаткин В. Н. и др. Техническая термодинамика / Под общ. ред. проф. Э. И. Гуйго. — Л. : Изд-во Ленингр. ун-та, 1984. — 296 с.
- Гуггенгейм. Современная термодинамика, изложенная по методу У. Гиббса / Пер. под ред. проф. С. А. Щукарева . — Л.—М.: Госхимиздат, 1941. — 188 с.
- Зубарев Д. Н. // Физическая энциклопедия . — Большая Российская энциклопедия , 1998. — Т. 5: Стробоскопические приборы — Яркость . — С. 236 .
- Карапетьянц М. Х. Химическая термодинамика. — М. : Химия, 1975. — 584 с.
- Квасников И. А. Термодинамика и статистическая физика. Т. 1: Теория равновесных систем: Термодинамика. — 2-е изд., сущ. перераб. и доп. — М. : Едиториал УРСС, 2002. — 240 с. — ISBN 5-354-00077-7 .
- Коган В. Е., Литвинова Т. Е., Чиркст Д. Э., Шахпаронова Т. С. Физическая химия / Науч. ред. проф. Д. Э. Чиркст. — СПб. : Национальный минерально-сырьевой ун-т «Горный», 2013. — 450 с.
- Колесников И. М. Термодинамика физико-химических процессов. — М. : Гос. акад. нефти и газа им. И. М. Губкина, 1994. — 288 с.
- Колесников И. М. Термодинамика физико-химических процессов. — М. : Нефть и Газ, 2005. — 480 с. — ISBN 5-7246-0351-9 .
- Коновалов В. И. Техническая термодинамика. — Иваново: Иван. гос. энерг. ун-т, 2005. — 620 с. — ISBN 5-89482-360-9 .
- Кубо Р. Термодинамика. — М. : Мир, 1970. — 304 с.
- Кудрявцева И. В., Рыков А. В., Рыков В. А. . — СПб. — Научный журнал НИУ ИТМО.- Статья. — УДК 536.71
- Куранов Г. Л. // Химическая энциклопедия . — Большая Российская энциклопедия , 1998. — Т. 5: Триптофан — Ятрохимия . — С. 39—40 .
- Маляренко В. А., Редько А. Ф., Чайка Ю. И., Поволочко В. Б. Техническая теплофизика ограждающих конструкций зданий и сооружений. — Харьков: Рубикон, 2001. — 280 с. — ISBN 966-7152-47-2 .
- Мурзаков В. В. Основы технической термодинамики. — М. : Энергия, 1973. — 304 с.
- Мюнстер А. Химическая термодинамика / Пер. с нем. под. ред. чл.-корр. АН СССР Я. И. Герасимова. — М. : Мир, 1971. — 296 с.
- Николаев Г. П., Лойко А. Э. Техническая термодинамика. — Екатеринбург: УрФУ, 2013. — 227 с.
- Партингтон Дж. Р., Раковский А. В. [libgen.io/book/index.php?md5=7e1f282c5a99198778a5d15a18a6018b Курс химической термодинамики] / Пер. с англ. Я. В. Герасимова, проработка и дополнения проф. А. В. Раковского. — 2-е изд., стереотипное. — М. — Л. : Госхимтехиздат , 1932. — 383 с.
- Полторак О. М. Термодинамика в физической химии. — М. : Высшая школа, 1991. — 320 с. — ISBN 5-06-002041-X .
- Путилов К. А. Термодинамика / Отв. ред. М. Х. Карапетьянц. — М. : Наука, 1971. — 376 с.
- Пыхачев Г. Б., Исаев Р. Г. Подземная гидравлика. — М. : Недра, 1973. — 360 с.
- Рыков С. В., Кудрявцева И. В., Рыков А. В., Курова Л. В. . — СПб. — Научный журнал НИУ ИТМО.- Статья. — УДК 536.71
- Рудой Ю. Г. // Большая российская энциклопедия . — Большая Российская энциклопедия (издательство) , 2017. — Т. 33 . — С. 65 .
- Сивухин Д. В. Общий курс физики. Т. II. Термодинамика и молекулярная физика. — 5-е изд., испр. — М. : ФИЗМАТЛИТ, 2005. — 544 с. — ISBN 5-9221-0601-5 .
- Сычёв В. В. Сложные термодинамические системы. — 5-е изд., перераб. и доп. — М. : Издательский дом МЭИ, 2009. — 296 с. — ISBN 978-5-383-00418-0 .
- Толпыго К. Б. [www.libgen.io/book/index.php?md5=9D8053F983EF1E982792F381F436A461 Термодинамика и статистическая физика]. — Киев: Изд-во Киевского ун-та, 1966. — 364 с. (недоступная ссылка)
- Щелкачев В. Н., Лапук Б. Б. Подземная гидравлика / Под общ. ред. акад. Л. С. Лейбензона. — М. — Л: Гостоптехиздат, 1949. — 524 с.
- Эпштейн П.С. Курс термодинамики / Пер.с англ. Н. М.Лозинской, Н. А.Толстого.. — ОГИЗ. — М. , 1948. — 420 с.
- 2020-02-11
- 1
































![{\displaystyle \left({\frac {\partial T}{\partial P}}\right)_{V}=\left[\left({\frac {\partial P}{\partial T}}\right)_{V}\right]^{-1},}](/images/007/660/7660696/34.jpg?rand=562592)
![{\displaystyle \left({\frac {\partial T}{\partial V}}\right)_{P}=\left[\left({\frac {\partial V}{\partial T}}\right)_{P}\right]^{-1},}](/images/007/660/7660696/35.jpg?rand=108864)
![{\displaystyle \left({\frac {\partial P}{\partial V}}\right)_{T}=\left[\left({\frac {\partial V}{\partial P}}\right)_{T}\right]^{-1},}](/images/007/660/7660696/36.jpg?rand=157689)