Interested Article - Оксид осмия(VIII)

- 2021-11-07
- 2
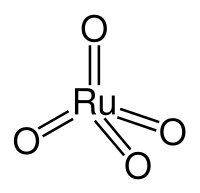
Окси́д о́смия(VIII) (тетраокси́д о́смия) — высший оксид осмия , брутто-формула (система Хилла) .
Физические свойства
Оксид осмия(VIII) при стандартных условиях представляет собой жёлто-коричневые кристаллы моноклинной сингонии с характерным запахом , напоминающим озон . Чистый тетраоксид осмия бесцветный, однако, предполагается, что его жёлтый оттенок обусловлен примесями оксида осмия(IV) .
Неустойчив, возгоняется уже при комнатной температуре .
Хорошо растворим в различных органических растворителях , умеренно растворим в воде , с которой он обратимо реагирует с образованием .
Молекулы оксида осмия(VIII) тетраэдрической формы и, следовательно, неполярны.
-
Оксид осмия(VIII) в ампуле
-
Оксид осмия(VIII) в ампуле
Получение
Взаимодействием металлического осмия с кислородом при высокой температуре:
- .
Также тетраоксид осмия можно получить окислением осматов(IV) азотной кислотой :
- .
Химические свойства
Тетраоксид осмия взаимодействует с концентрированной соляной кислотой :
- .
Тетраоксид осмия взаимодействует с щелочами с образованием перосматов (солей перосмиевой кислоты ):
- .
Восстанавливается водородом (при 25 °С) до оксида осмия(IV):
- .
Также его можно восстановить до оксида осмия(IV) оксидом азота(II) (при 600 °С):
- .
Нагреванием тетраоксида осмия в атмосфере монооксида углерода можно получить триядерный додекакарбонил осмия :
- .
В неполярных органических растворителях оксид осмия(VIII) присоединяется по двойным углеродным связям (C=C) непредельных органических соединений , образуя циклические эфиры осмиевой кислоты , которые гидролизуются до цис-диолов (процесс син-гидроксилирования).
Применение
- Краситель для микроскопии
- Используется в электронной микроскопии в качестве фиксатора и контрастного вещества
- Используется в органической химии как окислитель
Токсикология и техника безопасности
Оксид осмия(VIII) (тетраоксид осмия) летуч, очень токсичен и поэтому должен храниться в запаянных ампулах.
Известно, что Карл Карлович Клаус (1796—1864), известный российский химик , исследователь металлов платиновой группы , впервые получив тетраоксид осмия, писал, что « вкус у этого соединения острый, перцеподобный… »; позже, в апреле 1845 года , Клаус отравился парами этого вещества и на две недели был вынужден прекратить работы .
Примечания
- . InChem. Дата обращения: 14 декабря 2012. 16 декабря 2012 года.
- Holleman-Wiberg Lehrbuch der Anorganischen Chemie — 103 — Walter de Gruyter . — Т. 2. — С. 1975.
- ↑
- (англ.) : A CRC quick reference handbook — CRC Press , 1993. — ISBN 978-0-8493-4498-5
- Красицкий В. А. // Химия и химики : журнал. — М. , 2009. — № 5 . — С. 22—55 . 8 июля 2011 года. (Дата обращения: 10 ноября 2009)
Литература
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник». — Л.: Химия, 1977. — С. 89.
- «Неорганическая химия» под ред. Ю. Д. Третьякова. Том 3: Химия переходных элементов. Кн. 2: учебник для студентов высш. учеб. заведений/[А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов]. — М.: Издательский центр «Академия», 2007. — С. 49.
- 2021-11-07
- 2







![{\displaystyle {\ce {OsO4 + 10 HCl -> H2[OsCl6] + 2 Cl2 ^ + 4 H2O}}}](/images/007/672/7672092/19.jpg?rand=879073)

![{\displaystyle {\ce {OsO4 + 2 KOH -> K2[OsO4(OH)2]}}}](/images/007/672/7672092/21.jpg?rand=889679)


![{\displaystyle {\ce {3OsO4{}+24CO->[{\ce {165^{o}C,\ 80\ atm}}]Os3(CO)12{}+12CO2}}}](/images/007/672/7672092/24.jpg?rand=908751)