Interested Article - Опсин

- 2021-09-22
- 1

Опсины — это группа светочувствительных связанных с мембраной рецепторов , связанных с G-белками , массой около 35-55 кДа семейства ретинолидных белков, которые обнаружены в фоточувствительных клетках сетчатки . Пять групп опсинов принимают участие в зрении, передаче света в электрохимический сигнал, и являются первым этапом в каскаде зрительной трансдукции. — другой опсин, обнаруженный в сетчатке млекопитающих, который участвует в циркадианных ритмах и в зрачковом рефлексе, но не в формировании изображения.
Классификация
Классифицируют два типа опсинов — первого и второго типов. Сходство в их структуре и функции указывает на их конвергентное происхождение у бактерий и животных.
Опсины прокариот (первого типа)
Опсины прокариот имеют семь трансмембранных доменов, сходные по структуре с рецепторами, связанными с G-белками у эукариот. Но несмотря на такие сходства, нет никаких подтверждений того, что они имеют эволюционное сходство, по-видимому, эти белки эволюционировали независимо друг от друга.
Некоторые бактерии фиксируют углерод без участия хлорофилла, используя для этого опсины первого типа ( протеородопсины , халородопсины и бактериородопсины) Галобактерии используют чувствительные родопсины для фототаксиса, в этом процессе участвуют, связанные с плазматическими мембранами, белки системы передачи сигнала, не имеющие отношения к G-белкам.
Группы опсинов второго типа
Два семейства опсинов позвоночных классифицируют по различиям в экспрессии и эволюционной истории. Родопсины , которые участвуют в ночном зрении, являются высокочувствительными, нерезкими опсинами и располагаются в палочках сетчатки . Опсины колбочек, которые участвуют в цветном зрении, являются низкочувствительными но резкими опсинами, и располагаются в клетках колбочек сетчатки. Опсины колбочек также классифицируют по длине волн максимального поглощения света. Также для классификации часто сравнивают аминокислотные последовательности опсинов разных групп. Оба подхода выделяют четыре основных группы опсинов. У человека представлен следующий набор зрительных белков:
- Родопсин (Rh1, OPN2, ) — экспрессируется в палочках, участвует в ночном зрении
-
Четыре типа опсинов колбочек (
фотопсины
) — экспрессируются в колбочках, участвуют в цветном зрении
- Чувствительные в области длинных волн (Long Wavelength Sensitive, LWS, ) опсины — λ max в красном диапазоне
- Чувствительные в области волн средней длины (Middle Wavelength Sensitive, RH2 или MWS) опсины — λ max в зелёной части спектра
- Чувствительные в области коротких волн 2 (SWS2) опсины — λ max в синем диапазоне
- Чувствительные в области коротких волн 1 (SWS1) опсины — λ max в фиолетовой и ультрафиолетовой части диапазона
Для последних трех опсинов у человека известны гены , , и .
Другие животные имеют разные наборы фоторецепторных белков, и их соответствующие спектры поглощения отличаются от человеческих белков. Поэтому восприятие света и изображений у человека и животных отличается. Некоторые насекомые , например, могут видеть в ультрафиолетовом диапазоне, а животные с одним типом опсинов видят окружающий мир черно-белым.
Структура и функции
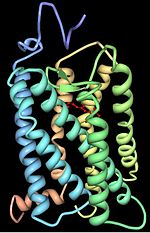
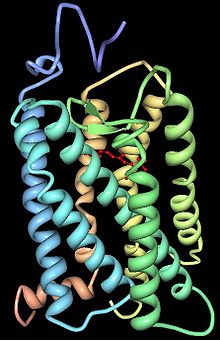
Опсины ковалентно связаны с ретиналем — альдегидной формой витамина А , связывание идет через конденсацию альдегидной группы ретиналя с ε-аминогруппой остатка лизина в седьмой трансмембранной альфа-спирали с образованием основания Шиффа . У позвоночных хромофор находится в цис-форме. Поглощение фотона приводит к изменению конформации в транс-состояние. Фотоизомеризация вызывает конформационные изменения в белке опсине и активирует каскад фототрансдукции.
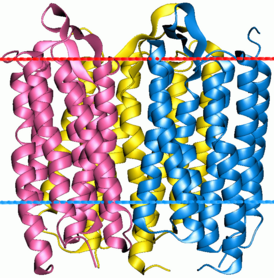
Опсины содержат семь трансмембранных альфа-спиральных доменов, соединенных тремя внеклеточными и тремя цитоплазматическими петлями. Многие остатки аминокислот являются эволюционно консервативными между разными группами опсинов. Остаток Lys296 консервативен во всех известных опсинах и служит сайтом связывания основания Шиффа с хромофором.
См. также
Примечания
-
↑
Fernald, Russell D. (2006), "Casting a Genetic Light on the Evolution of Eyes",
Science
,
313
(5795): 1914—1918,
doi
:
,
PMID
{{ citation }}: Неизвестный параметр|month=игнорируется ( справка ) -
Römpler H, Stäubert C, Thor D, Schulz A, Hofreiter M, Schöneberg T (2007), "G protein-coupled time travel: evolutionary aspects of GPCR research",
Molecular Interventions
,
7
(1): 17–25,
doi
:
,
PMID
{{ citation }}: Неизвестный параметр|month=игнорируется ( справка ) Википедия:Обслуживание CS1 (множественные имена: authors list) ( ссылка ) - Terakita A. The Opsins (англ.) // : journal. — 2005. — Vol. 213 , no. 6(3) . — P. 213 . — doi : .
- Palczewski K et al . Crystal Structure of Rhodopsin: A G Protein-Coupled Receptor (англ.) // Science : journal. — 2000. — Vol. 289 , no. 5480 . — P. 739—745 . — doi : . — .
- 2021-09-22
- 1