Interested Article - Ацетилацетон

- 2021-03-23
- 1
Ацетѝлацето́н ( диацетилметан , пентан-2,4-дион ) СН 3 -СО-СН 2 -СО-СН 3 — органическое соединение , относящееся к классу кетонов с формулой C 5 H 8 O 2 . Этот дикетон имеет формальное название 2,4-пентандион. Он является прекурсором для синтеза ацетилацетонатов (Aсaс, от англ . Ac etyl ac etone), распространённый лиганд . Также является строительным блоком для синтеза гетероциклических соединений .
Свойства
Бесцветная жидкость с запахом ацетона и уксусной кислоты.
Кетонная и енольная формы ацетилацетона сосуществуют в растворе; эти формы являются таутомерами . C 2v симметрия для енола , показанного на левой части схемы, была подтверждена разными методами, в том числе и микроволновой спектроскопией . Водородная связь в еноле уменьшает стерическое отталкивание между карбонильными группами. В газовой фазе константа равновесия равена 11,7. Константа равновесия стремится к увеличению в неполярных растворителях: циклогексан — 42, толуол — 10, ТГФ — 7,2, ДМСО — 2, в воде 0,23 . Енольная форма является винилогом карбоновой кислоты .

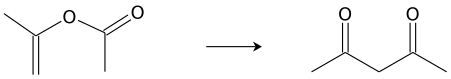
Получение
В промышленности ацетилацетон получают термической перегруппировкой изопропенилацетата
Лабораторный синтез ацетилацетона начинается с ацетона . Ацетон и уксусный ангидрид при добавке BF 3 в качестве катализатора :
Второй синтез включает катализируемая основаниями конденсация ацетона и этилацетата , с последующим подкислением.
- NaOEt + EtO 2 CCH 3 + CH 3 C(O)CH 3 → NaCH 3 C(O)CHC(O)CH 3 + 2 EtOH
- NaCH 3 C(O)CHC(O)CH 3 + HCl → CH 3 C(O)CH 2 C(O)CH 3 + NaCl
Благодаря лёгкости этих синтезов известно много аналогов ацетилацетонатов. Некоторые примеры включают C 6 H 5 C(O)CH 2 C(O)C 6 H 5 (dbaH) и (CH 3 ) 3 CC(O)CH 2 C(O)CC(CH 3 ) 3 . Гексафторацетилацетонаты (F 3 CC(O)CH 2 C(O)CF 3 ) широко используются для получения летучих комплексов металлов.
Ацетилацетонат-анион
Ацетилацетонат-анион, C 5 H 7 O 2 − , является 2,4-пентандиона. Он не существует свободно в виде аниона в растворе, напротив, он связан с соответствующим катионом , таким как Na + . На практике существование свободного аниона, обычно обозначаемого acac − , только удобная модель. Ацетилацетонат натрия может быть получен ацетилацетона гидроксидом натрия в смеси вода- метанол .
Координационная химия
С ионами металлов ацетилацетон дает прочные комплексные соединения , которые используют в аналитической химии для определения и разделения бериллия , меди , хрома , железа и других металлов; в радиохимии — для выделения радиоактивных изотопов .
Ацетилацетонат анион образует комплексы с многими ионами переходных металлов , где оба атома кислорода связаны с металлом, образуя шестичленные хелатные комплексы. Некоторые примеры, включая Mn(acac) 3 , , , Fe(acac) 3 , и Co(acac) 3 . Любой комплекс с формулой M(acac) 3 хирален (имеет несовместимость со своим отражением в зеркале). Комплексы M(acac) 3 могут быть восстановлены электрохимически; глубина восстановления зависит от растворителя и металлического центра Бис- и трис-комплексы типа M(acac) 2 и M(acac) 3 в основном растворимы в органических растворителях, в противоположность соответствующим галогенидам. Важное применение включает в себя использование их в 1 Н ЯМР в качестве «смещающего реагента» и в качестве катализаторов в органическом синтезе, а также прекурсоров к промышленным катализаторам гидроформилирования. C 5 H 8 O 2 − соединения в некоторых случаях происходит через центральный углеродный атом; этот тип связывания более характерен для переходных металлов третьего ряда, таких как платина (II) и иридий (III).
Ацетилацетонаты металлов
Ацетилацетонат хрома(III)
используется как спин-релаксационный агент для увеличения чувствительности в количественной углерод-13 ЯМР спектроскопии
Трис-ацетилацетонат хрома представляет собой красно-фиолетовые кристаллы, похожие на блёстки.
Одним из способов его получения является взаимодействие с ацетилацетоном в присутствии некоторого количества уксусной кислоты при длительном кипячении.
Cr(CH 3 COO) 3 + 3H-acac = 3CH 3 COOH + Cr(acac) 3
Ацетилацетонат меди(II)
Cu(acac) 2 получается обработкой ацетилацетона водным раствором Cu(NH 3 ) 4 2+ и доступен коммерчески, катализирует сочетание или реакции переноса карбена.
Ацетилацетонат меди(I)
В отличие от производных меди(II), ацетилацетонат меди(I) чувствителен к воздуху. Он используется в качестве катализатора реакции Михаэля .
Ацетилацетонат марганца(III)

Ацетилацетонат марганца(III) , Mn(acac) 3 , одноэлектронный окислитель, используется для сочетания фенолов. Его получают либо конпропорционированием Mn(acac) 2 с перманганатом калия и избытком ацетилацетона, либо прямой реакцией ацетилацетона с перманганатом калия. В терминах электронной структуры, Mn(acac) 3 является высокоспиновым. Октаэдрическая структура искажена благодаря эффекту Яна — Теллера . Две наиболее общие структуры для этого комплекса включает одну с тетрагональным увеличением и одну с тетрагональным сжатием. Для увеличения, длины двух Mn-O связей равны 2,12 Å, в то время как остальные четыре — 1,93 Å. Для сжатия, длины двух Mn-O связи равны 1,95 Å, остальные четыре — 2,00 Å. Эффект тетрагонального увеличения заметно более существен, чем эффект тетрагонального сжатия.
Ацетилацетонат никеля(II)

Ацетилацетонат никеля(II) — это не Ni(acac) 2 , а тример [Ni(acac) 2 ] 3 . Твёрдое вещество изумрудно-зелёного цвета, нерастворимо в бензоле. Широко используется для получения Ni(O)-комплекса. Под действием влаги воздуха [Ni(acac) 2 ] 3 переходит в зеленоватый мономерный гидрат.
Ацетилацетонат ванадила

— сине-зелёный комплекс с формулой V(O)(acac) 2 . Плохо растворим в воде. Хорошо растворим в органических растворителях. Водный раствор окрашивает в тёмно-зелёный цвет. Он полезен в эпоксидировании аллильных спиртов.
Ацетоноацетат цинка
Моногидрокомплекс Zn(acac) 2 H 2 O (температура плавления 138—140 °C) пятикоординатный, принимает форму квадратной пирамиды . Дегидратация этих веществ даёт гигроскопическое сухое производное (температура плавления 127 °C) . Это более летучее производное использовалось как прекурсор для плёнок ZnO
Ацетоноацетат иридия
Иридий(I) и иридий(III) образуют стабильные ацетилацетонатные комплексы. Ir(III)-производные, включая транс -Ir(acac) 2 ( C H(COMe) 2 )(H 2 O) и более распространённый D 3 -симметричный Ir(acac) 3 . Производные с С-связью являются прекурсором для гомогенных катализаторов для C-H активирования и соответствующих химий Иридий(I)-производные включают планарно-квадратный Ir(acac)(CO) 2 ( C 2v -симметрия).
Алюминий(III) ацетилацетонат
Al(C 5 H 7 O 2 ) 3 , или сокращённо Al(acac) 3 , образует кристаллический желтоватый осадок при прямой реакции ацетилацетона с растворимой солью алюминия в щелочной среде при нагревании.
C-связанные ацетилацетонаты
C 5 H 7 O 2 − в некоторых случаях также связывает металл через центральный атом углерода (C3); этот способ связывания характерен для металлов третьего переходного ряда, таких как платина(II) и иридий(III). Комплекс Ir(acac) 3 и соответствующий аддукт с основанием Льюиса Ir(acac) 3 L (L = an амин ) содержат один углеродно-связанный acac лиганд. ИК-спектры О-связанных ацетилацетонатов характеризуется относительно малоэнергетическим νCO линиями при 1535 см −1 , тогда как в углеродно-связанном ацетилацетонате наблюдается линия поглощения νC=O при 1655 см −1 , характерная для кетонов.
Другие реакции ацетилацетона
- Депротонирование: очень сильные основания могут дважды депротонировать ацетилацетон, начиная с С3, а также С1. Образующееся вещество может быть проалкилировано по атому C-1.
- Прекурсор для синтеза гетероциклов: Ацетилацетон — многофункциональный прекурсор гетероциклов . Так, гидразин даёт при конденсации с ацетилацетонами замещенные пиразолы , а мочевина — пиримидины .
- Прекурсор соответствующих имино-лигандов: ацетилацетон конденсируется с аминами, давая моно- и ди-кетимины, в которых один либо два атома кислорода ацетилацетона, соответственно, замещаются на группу NR (где R = арил , алкил ).
- Фермент разрывает связь углерод-углерод с образованием ацетата и 2-оксопропаналя. Фермент Fe(II) зависим, но было доказано соединение также с цинком. Деградация ацетилацетона была охарактеризивана в бактерии johnsonii .
- C 5 H 8 O 2 + O 2 → C 2 H 4 O 2 + C 3 H 4 O 2
- Арилирование: ацетилацетонат замещает галиды из обычной галогенозамещённой бензойной кислоты. Реакция катализируется медью.
- 2-BrC 6 H 4 CO 2 H + NaC 5 H 7 O 2 → 2-(CH 3 CO) 2 HC)-C 6 H 4 CO 2 H + NaBr
Безопасность
КПВ 2.4-11.6 %
См. также
- Ацетилацетонат бериллия
- Ацетилацетонат палладия(II)
- Ацетилацетонат празеодима(III)
- Ацетилацетонат родия(III)
- Ацетилацетонат рутения
- Ацетилацетонат самария
- Ацетилацетонат свинца(II)
- Ацетилацетонат цинка
Примечания
- . Sigma-Aldrich .
- Caminati W., Grabow J.-U. The C2v Structure of Enolic Acetylacetone (англ.) // . — 2006. — Vol. 128 , no. 3 . — P. 854—857 . — doi : .
- Solvents and Solvent Effects in Organic Chemistry , Christian Reichardt Wiley-VCH; 3 edition 2003 ISBN 3-527-30618-8
- Siegel H., Eggersdorfer M. «Ketones» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, Wienheim. doi :
- Snider B. B. , «Manganese(III) Acetylacetonate» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi :
- Fawcett W., Opallo M. Kinetic parameters for heterogeneous electron transfer to tris(acetylacetonato)manganese(III) and tris(acetylacetonato)iron(III) in aproptic solvents (англ.) // . — 1992. — Vol. 331 . — P. 815—830 . — doi : .
- Caytan E. et al. Precise and accurate quantitative 13 C NMR with reduced experimental time (англ.) // . — 2007. — Vol. 71 , no. 3 . — P. 1016—1021 . — doi : .
- Parish E. J., Li S. «Copper(I) Acetylacetonate» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi :
- Montgomery H., Lingafelter E. C. The crystal structure of monoaquobisacetylacetonatozinc (англ.) // Acta Crystallographica. — 1963. — Vol. 16 . — P. 748—752 . — doi : .
- Rudolph G., Henry M. C. Bis(2,4-Pentanedionato)zinc (Zinc Acetylacetonate) (англ.) // Inorganic Syntheses. — 1967. — Vol. X . — P. 74—77 .
- Bennett M. A., Mitchell T. R. B. γ-Carbon-bonded 2,4-pentanedionato complexes of trivalent iridium (англ.) // Inorganic Chemistry. — 1976. — Vol. 15 . — P. 2936—2938 . — doi : .
- Bhalla G., Oxgaard J., Goddard W. A., Periana R. A. Hydrovinylation of Olefins Catalyzed by an Iridium Complex via CH Activation (англ.) // Organometallics. — 2005. — Vol. 24 . — P. 5499-5502 . — doi : .
- Straganz, G.D., Glieder, A., Brecker, L., Ribbons, D.W. and Steiner, W. «Acetylacetone-Cleaving Enzyme Dke1: A Novel C-C-Bond-Cleaving Enzyme.» Biochem. J. 369 (2003) 573—581 doi :
- 2021-03-23
- 1