Interested Article - Пропилен

- 2021-09-20
- 1
Пропиле́н ( пропе́н , метилэтиле́н , химическая формула — C 3 H 6 ) — органическое соединение , относящееся к классу непредельных углеводородов — алкенов ( олефинов ).
При нормальных условиях , пропилен — это бесцветный газ со слабым неприятным запахом.
Химические свойства
Пропилен обладает широким набором химических свойств, которые определяются наличием двойной углерод-углеродной связи . Прежде всего, пропилен склонен к реакциям присоединения с разрывом π-связи . Эти превращения часто протекают по гетеролитическому типу и относятся к реакциями электрофильного присоединения .

Реакции присоединения
1. Гидрирование . Пропилен вступает в реакцию с водородом в присутствии типичных катализаторов, например никеля или платины .
2. Пропилен реагирует с галогеноводородами и серной кислотой , давая продукт присоединения по двойной связи (галогенпропан или ). Пропилен является несимметричным алкеном, поэтому при присоединении этих реагентов он может давать два изомерных продукта, из которых (согласно правилу Марковникова ) преобладает более замещённый галогенид или эфир .
3. По аналогичной схеме в присутствии кислотного катализатора пропилен реагирует с водой, давая изопропиловый спирт .
4. Галогенирование . Пропилен быстро реагирует с галогенами, давая дигалогениды. Быстрее всего в реакцию вступает фтор (со взрывом), медленно реагирует иод . В присутствии посторонних нуклеофилов , кроме дигалогенидов, могут получаться также продукты сопряжённого присоединения .
5. Пропилен вступает в реакции , образуя масляный и , а при повышенной температуре — соответствующие им спирты ( бутиловый спирт и изобутиловый спирт ) .
Реакции окисления
Для пропилена характерен ряд реакций окисления . При взаимодействии с раствором перманганата калия в слабощелочной среде он превращается в пропиленгликоль . Оксид хрома(VI) расщепляет алкены по двойной связи с образованием кетонов и карбоновых кислот . Аналогичному расщеплению пропилен подвергается в условиях реакции .
При взаимодействии с надкислотами пропилен даёт . Аналогичная реакция протекает и с кислородом воздуха в присутствии серебряного катализатора .
Реакции полимеризации
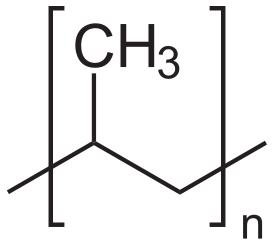
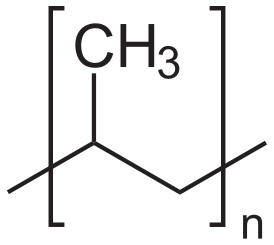
Пропилен вводят в радикальную полимеризацию , получая атактический полипропилен высокого давления, имеющий нерегулярное строение. Напротив, пропилена на катализаторах Циглера — Натты даёт изотактический полипропилен низкого давления, имеющий более высокую температуру размягчения .
Реакции по аллильному положению
Пропилен вступает в реакции по аллильному положению. При 500 °С он хлорируется, образуя аллилхлорид .
Лабораторное получение
1. В лабораторных условиях пропилен получают стандартными методами получения алкенов. Так, пропилен можно получить дегидратацией пропилового или изопропилового спирта нагреванием в присутствии серной кислоты .
2. Пропилен получают из галогенидов путём отщепления галогеноводорода или из дигалогенидов путём отщепления галогена .
Пропин можно частично гидрировать до пропилена в присутствии отравленных катализаторов .
Промышленное производство
В течение долгого времени пропилен получали как побочный продукт в процессах парового и каталитического крекинга углеводородов. С 1990-х годов заводы парового крекинга переориентировались на производство этилена, в ходе которого пропилен как побочный продукт не образуется. Соответственно, компенсация этого процесса происходит за счёт методов целевого получения пропилена. В некоторых регионах эти методы оказываются более выгодными за счёт дешёвого сырья .
Побочный продукт в производстве этилена
В процессе производства этилена методом крекинга в депропанизаторе выделяется безводная, обессеренная фракция C 3 , которая содержит пропан , пропилен, пропадиен и пропин , а также следы углеводородов С 2 и С 4 . Доля пропадиена и пропина может достигать 8 мол. %, поэтому эту фракцию селективно гидрируют на палладиевых катализаторах, рассчитывая количество водорода так, чтобы превратить углеводороды C 3 H 4 в C 3 H 6 , но не позволить пропену превратиться в пропан. При жидкофазном гидрировании эту стадию контролируют парциальным давлением водорода, а при газофазном гидрировании — регулированием температуры в пределах 50—120 °С. При необходимости пропилен затем очищают от пропана в специальной колонне .
Побочный продукт нефтепереработки
Пропилен, получаемый при нефтепереработке, также образуется в ходе процессов крекинга, однако эти процессы существенно отличаются от получения этилена паровым крекингом, так как используется другое сырьё, а процессы проводятся с другой целью. Для получения пропилена основным процессом является жидкостный каталитический крекинг ( англ. fluid catalytic cracking ), в котором катализатор используется в виде кипящего слоя . В ходе этого процесса тяжёлый газойль превращается в бензин и лёгкий газойль. При этом пропилен получается в количестве 3 %, однако его долю можно повысить до 20 % путём модификации катализатора .
Пропилен также является побочным продуктом термического крекинга и образуется в процессе коксования и висбрекинга . В случае коксования остаток от перегонки сырой нефти в жёстких условиях разлагают до газойля, кокса, бензина и крекинг-газа (6—12 % последнего). В этом крекинг-газе присутствует фракция С 3 в количестве 10—15 мол. %, из которой и получают пропилен. При висбрекинге происходит более мягкий крекинг, нацеленный на уменьшение вязкости смеси. При этом также образуется небольшое количество крекинг-газа .
Целевое получение пропилена
В связи с изменением структуры производства пропилена всё большее значение приобретают методы его целевого получения. В США доступность дешёвого пропана, получаемого из сланцевого газа , привела к разработке экономичных методов дегидрирования пропана до пропилена. Аналогичная ситуация наблюдается и в Саудовской Аравии , которая имеет запасы дешёвого пропана. Другим способом промышленного синтеза пропилена является метатезис этилена и бутена-2. Он особенно перспективен при наличии источников дешёвого бутена и этилена. Наконец, пропилен можно получать из угля: путём газификации синтезируется метанол , который затем превращается в этилен и пропилен .
Дегидрирование пропана
Дегидрирование пропана — это эндотермическая реакция, которую проводят в присутствии платиновых и хромовых катализаторов на специальных носителях. Селективность этой реакции составляет 85-92 %. Согласно принципу Ле-Шателье , выход пропилена повышается при увеличении температуры и уменьшении давления. Однако высокая температура приводит к побочному процессу разложения пропана на метан и этилен, а также к образованию пропадиена. Поэтому дегидрирование пропана проводят при 500—700 °С и атмосферном (или чуть более низком) давлении .
Существует несколько реализаций этого процесса под названиями Oleflex, Catofin и STAR. Они отличаются друг от друга устройством реакторов, применяемыми катализаторами и методами регенерации катализаторов. В некоторых случаях пропан дополнительно разбавляют водородом или паром, чтобы снизить его парциальное давление .
Метатезис
Метатезис алкенов представляет собой химический процесс, в котором две молекулы алкенов перегруппировываются, формально обмениваясь друг с другом заместителями. Соответственно, к пропилену в такой схеме приводит метатезис бутена-2 и этилена .
В 1960-е годы этот процесс проводился в обратную сторону: компания Phillips проводила так называемый триолефиновый процесс, превращая пропен в бутен-2 и этилен с целью получения последнего. В 1972 году это производство было остановлено в связи с ростом потребности в пропилене. С тех пор процесс проводится в сторону образования пропилена; его доля в производстве пропилена составляет 3 % .
Крекинг и интерконверсия алкенов
В данном процесс смеси алкенов пропускают над катализатором с целью перераспределения соотношения между компонентами. Условия подбирают таким образом, чтобы основным компонентом этой смеси стал пропилен. Исключительно этот метод используют лишь немногие заводы: более экономично использовать его в комбинации с другими подходами .
Производство из метанола
Исходным сырьём в этом методе является газ либо уголь. Сначала их превращают в синтез-газ , который затем превращают в метанол . Метанол затем превращается в этилен и пропилен. Соотношение этилена и пропилена можно регулировать от примерно равных количеств до селективного получения пропилена с выходом 70 % :
Экономические аспекты

|

|
Большая часть производственных мощностей по пропилену сосредоточена в Европе, Северной Америке и Азии. По состоянию на 2011 год в мире производилось более 78 млн тонн пропилена. Из этого количества 58 % приходилось на заводы по производству этилена паровым крекингом, 32 % — на заводы по каталитическому крекингу нефти, 10 % — на целевой синтез пропилена .
Хранение и транспортировка

Большая трубопроводная сеть для пропилена существует в США (штаты Техас и Луизиана ); также небольшая сеть есть в странах Бенилюкса . В остальных странах пропилен перемещают по автодорогам, железной дороге или по морю, что приводит к необходимости иметь большие склады как на стороне производителя, так и на стороне потребителя .
При обычных температурах жидкий пропилен хранят под давлением в цистернах до 20 м в диаметре. Также его можно хранить в больших количествах без давления при температуре −47 °С. По железной дороге пропилен перемещают под давлением: в стандартную цистерну помещается 42 т пропилена. По автодорогам можно перевезти 20 т пропилена, поскольку суммарный вес автомобиля ограничен 40 т. По морю перевозят как небольшие цистерны под давлением, так и сжиженный пропилен при низкой температуре .
Применение
| Продукт |
Расходование
пропилена, % |
|---|---|
| Полипропилен | 63,9 |
| 7,7 | |
| Акрилонитрил | 7,1 |
| Кумол | 5,6 |
| Акриловая кислота | 3,6 |
| Изопропиловый спирт | 1,6 |
| Другие | 10,5 |
В 1990-е годы сферы использования пропилена изменились, поскольку его цена возросла и в некоторых местах возникла его нехватка. Соответственно, практически прекратилось его использование, связанное со сжиганием; кроме того, пропилен начали выделять из фракций крекинга при любой возможности .
Для использования в промышленности пропилен выпускается с тремя степенями чистоты:
- нефтехимический пропилен (50—70 % пропилен в пропане) получают в процессах крекинга; такой пропилен используют в производстве сжиженного нефтяного газа, как присадку для повышения октанового числа моторных топлив и в некоторых химических синтезах;
- химически чистый пропилен используют для промышленного синтеза некоторых продуктов;
- пропилен для полимеризации содержит минимальные количества примесей, способных отравлять катализаторы полимеризации .
По состоянию на 2013 год большая часть пропилена (около 2/3) расходуется на получение полипропилена — полимера, занимающего 25 % среди всех пластмасс.
Также из пропилена получают , акриловую кислоту , акрилонитрил , пропиленгликоль и кумол . Производство полипропилена и акриловой кислоты возрастает, поэтому ожидается повышение спроса на пропилен .
Токсическое действие
Как и другие алкены, пропилен действует на животных как сильный наркотик , хоть это воздействие обнаруживается при концентрациях пропилена в воздухе порядка десятков процентов. Минимальная наркотическая концентрация в смеси с воздухом или кислородом составляет около 40—50 % (мыши, крысы, кошки, собаки). Концентрация 65—80 % для животных летальна. Человек ощущает запах пропилена в концентрации свыше 0,0173—0,024 мг/л. При концентрации в воздухе 15 % человек теряет сознание через 30 мин, при 24 % — через 3 мин, при 35—40 % — через 20 с .
Примечания
- ↑ .
- . Sigma-Aldrich . Дата обращения: 22 апреля 2019.
- . Cameo Chemicals — NOAA . Дата обращения: 22 апреля 2019. 22 апреля 2019 года.
- ↑ Дата обращения: 24 апреля 2019. 24 апреля 2019 года.
- Дата обращения: 24 апреля 2019. 24 апреля 2019 года.
- Дата обращения: 24 апреля 2019. 24 апреля 2019 года.
- (англ.) : A CRC quick reference handbook — CRC Press , 1993. — ISBN 978-0-8493-4498-5
- , с. 109.
- ↑ , с. 110–114.
- , с. 115–116.
- ↑ , с. 116–118.
- , с. 118–122.
- , с. 123–124.
- ↑ , с. 105–106.
- , p. 1–2.
- , p. 2–3.
- ↑ , p. 3–5.
- , p. 5.
- ↑ , p. 5–9.
- ↑ , p. 9–10.
- , p. 10.
- , p. 12.
- , p. 2.
- ↑ , p. 13.
- ↑ , p. 14–16.
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей : в 3 т. / Под ред. Н. В. Лазарева и Э. Н. Левиной. — Л. : Химия, 1976. — Т. 1. — С. 21—22.
Литература
- Далин М. А. Пропилен // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров . — М. : Большая Российская энциклопедия , 1995. — Т. 4: Полимерные — Трипсин. — С. 103. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8 .
- Zimmermann H. Propene (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2013. — doi : .
- Нейланд О. Я. Органическая химия. — М. : Высшая школа, 1990. — С. 218–236. — ISBN 5-06-001471-1 .
- Андреас Ф., Гребе К. Химия и технология пропилена / Пер. с нем. В. Н. Тихомировой и Э. З. Черниной, под ред. З. Н. Полякова. — Ленинград : Химия, 1973.
- ГОСТ 24975.0-89 (СТ СЭВ 1499-79) Этилен и пропилен. Методы отбора проб
- 2021-09-20
- 1
![{\displaystyle {\mathsf {CH_{3}CH\!\!=\!\!CH_{2}+H_{2}{\xrightarrow[{}]{Ni}}CH_{3}CH_{2}CH_{3}}}.}](/images/008/285/8285815/9.jpg?rand=859094)

![{\displaystyle {\mathsf {CH_{3}CH\!\!=\!\!CH_{2}+H_{2}O{\xrightarrow[{}]{H^{+}}}CH_{3}CH(OH)CH_{3}(+CH_{3}CH_{2}CH_{2}OH)}}}](/images/008/285/8285815/11.jpg?rand=982593)

![{\displaystyle {\mathsf {CH_{3}CH\!\!=\!\!CH_{2}+Cl_{2}{\xrightarrow[{}]{H_{2}O}}CH_{3}CH(OH)CH_{2}Cl}}.}](/images/008/285/8285815/13.jpg?rand=91352)
![{\displaystyle {\mathsf {CH_{3}CH\!\!=\!\!CH_{2}+CO+H_{2}{\xrightarrow[{}]{Co}}CH_{3}CH_{2}CH_{2}CHO+(CH_{3})_{2}CHCHO}}.}](/images/008/285/8285815/14.jpg?rand=514845)
![{\displaystyle {\mathsf {CH_{3}CH\!\!=\!\!CH_{2}{\xrightarrow[{}]{KMnO_{4},H_{2}O}}CH_{3}CH(OH)CH_{2}OH}}.}](/images/008/285/8285815/15.jpg?rand=972507)
![{\displaystyle {\mathsf {CH_{3}CH\!\!=\!\!CH_{2}+Cl_{2}{\xrightarrow[{}]{t}}CH_{3}CH\!\!=\!\!CHCl+HCl}}.}](/images/008/285/8285815/16.jpg?rand=958571)
![{\displaystyle {\mathsf {CH_{3}CH(OH)CH_{3}{\xrightarrow[{}]{H^{+}}}CH_{3}CH\!\!=\!\!CH_{2}+H_{2}O}}.}](/images/008/285/8285815/17.jpg?rand=92565)
![{\displaystyle {\mathsf {CH_{3}CHBrCH_{3}{\xrightarrow[{}]{KOH}}CH_{3}CH\!\!=\!\!CH_{2}+KBr+H_{2}O}},}](/images/008/285/8285815/18.jpg?rand=489753)
![{\displaystyle {\mathsf {CH_{3}CHClCH_{2}Cl{\xrightarrow[{}]{Zn}}CH_{3}CH\!\!=\!\!CH_{2}+ZnCl_{2}}}.}](/images/008/285/8285815/19.jpg?rand=631873)
![{\displaystyle {\mathsf {CH_{3}C\!\!\equiv \!\!CH+H_{2}{\xrightarrow[{}]{Pd,PbCO_{3}}}CH_{3}CH\!\!=\!\!CH_{2}}}.}](/images/008/285/8285815/20.jpg?rand=99150)
![{\displaystyle {\mathsf {CH_{3}CH_{2}CH_{3}{\xrightarrow[{}]{t,cat}}CH_{3}CH\!\!=\!\!CH_{2}+H_{2}}}.}](/images/008/285/8285815/21.jpg?rand=744419)
![{\displaystyle {\mathsf {CH_{3}CH\!\!=\!\!CHCH_{3}+CH_{2}\!\!=\!\!CH_{2}{\xrightarrow[{}]{WO_{3}}}2CH_{3}CH\!\!=\!\!CH_{2}}}.}](/images/008/285/8285815/22.jpg?rand=224802)