Interested Article - Этилендиамин

- 2021-07-30
- 1
Этилендиамин (1,2-диаминоэтан) H 2 NCH 2 CH 2 NH 2 — органическое соединение класса аминов . Это широко используемый строительный блок в химическом синтезе, так что уже в 1998 году его производство составляло 500 млн кг.
Свойства
Жидкость без цвета с запахом аммиака, дымит при контакте с влажным воздухом. t kип 116,5 °C, t пл 8,5 °C, плотность 0,899 г/см³ (20 °C); Этилендиамин хорошо растворяется в воде (с разогреванием раствора), этаноле , хуже — в эфире , нерастворим в бензоле и других углеводородах. Является сильным основанием .
Имея в своей молекуле две аминогруппы, образует с кислотами два ряда солей. С некоторыми металлами (например, Cu, Mn, Co) образует комплексные соединения.
Динитрат этилендиамина при нагревании превращается в этилендинитрамин , являющийся взрывчатым веществом :
Вступает в реакции конденсации: при повышенных температурах и давлении и присутствии катализаторов превращается в пиперазин ; при конденсации с 1,2-дикетонами - 2,3-дигидропиразинами; при реакции с мочевиной - этиленмочевину (2-имидазолининон).
Применение
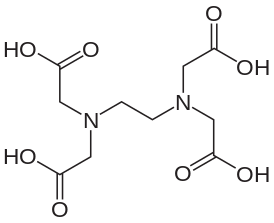
Этилендиамин применяется для получения этилендиаминтетрауксусной кислоты взаимодействием с хлоруксусной кислотой . Его соли с жирными кислотами используются как смягчающие агенты при производстве текстиля . Также этилендиамин применяется в производстве красителей , эмульгаторов , стабилизаторов латексов , пластификаторов и фунгицидов , лекарственных препаратов ( супрастин , эуфиллин , ранитидин ).
Получение
Основным способом синтеза этилендиамина в промышленности является взаимодействие аммиака с дихлорэтаном :
Кроме того, его можно получить по реакции каталитического гидрирования смеси моноэтаноламина с аммиаком при 150—230 °C.
К другим методам синтеза относятся реакция этилена с аммиаком либо формальдегида с аммиаком и циановодородом .
Токсичность
1,2-диаминоэтан обладает умеренно-токсическим действием . ЛД50 на крысах при пероральном введении составляет 1200 мг/кг.
Этилендиамин в больших количествах может раздражать кожу и слизистые оболочки верхних дыхательных путей, вызывает поражение печени.
ПДК паров в атмосферном воздухе составляет 0,03 мг/м 3 , в воздухе рабочей зоны 2 мг/м 3 , в воде водоёмов 0,2 мг/м 3 .
Вещество относится к III классу опасности по ГОСТ 12.1.005-88.
Литература
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М. : Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9 .
- , Менделеев Д. И. ,. // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб. , 1890—1907.
Ссылки
- ↑ (англ.) : A CRC quick reference handbook — CRC Press , 1993. — ISBN 978-0-8493-4498-5
- Hall H. K. (англ.) // / — ACS , 1957. — Vol. 79, Iss. 20. — P. 5441—5444. — ISSN ; ; —
- Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag, Weinheim. doi :
- Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), Seite 245, Wiley VCH
- name= (недоступная ссылка)
- 2021-07-30
- 1