Interested Article - Ротавирусы

- 2021-04-14
- 1
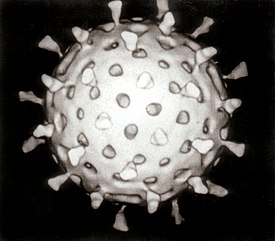
Ротавирусы ( лат. Rotavirus ) — род вирусов с двунитевой сегментированной РНК , принадлежащий к семейству реовирусов ( Reoviridae ), возбудители ротавирусной инфекции .
Внешний вид частиц напоминает «колесо с широкой ступицей, короткими спицами и чётко очерченным ободком» , из-за чего они и получили своё название (от лат. — «колесо»).
Виды
Известно 9 видов данного рода, обозначаемых латинскими буквами A—J . Человек может инфицироваться видами A, B и C, при этом возбудителем более 90 % ротавирусных инфекций является наиболее часто встречаемый вид — ротавирус A. Виды с A по D могут вызывать болезни у других животных . К виду Ротавирус A относится несколько серотипов . Как и в случае с вирусом гриппа , здесь применяется двойная классификация по подтипам поверхностных белков: серотипы G определяются вариациями гликопротеина VP7, а серотипы P — протеазочувствительным белком VP4 . Поскольку гены, определяющие G- и P-типы, наследуются независимо друг от друга, встречаются различные их комбинации .
Структура
Геном ротавируса состоит из 11 уникальных двунитевых молекул РНК , состоящих в общей сложности из 18 555 нуклеотидов . Нити нумеруются от 1 до 11 в порядке уменьшения длины, каждая представляет собой один ген . Каждый ген кодирует один белок , за исключением гена 9, кодирующего два белка . РНК окружена трёхслойным белковым капсидом в форме усечённого икосаэдра . Каждый из слоёв сложен отдельным вирусным белком. Внутренний и средний слои перфорированы каналами. Средний слой визуально содержит «спицы колеса» (белок VP6) и является важнейшим компонентом вириона. Размер вируса — 76,5 нм в диаметре , суперкапсида нет .
Белки
Вирион сформирован шестью структурными вирусными протеинами (VP), которые обозначаются как VP1, VP2, VP3, VP4, VP6 и VP7. Инфицированная вирусом клетка продуцирует также шесть неструктурных белков (NSP), не являющихся частью вирусной частицы. Они обозначаются: NSP1, NSP2, NSP3, NSP4, NSP5 и NSP6.

По крайней мере шесть из двенадцати кодируемых геномом вируса белков связываются с РНК . Роль этих белков в репликации вируса до конца не выяснена; их функции, как считается, относятся к синтезу РНК и его упаковке в вирион, транспортировке мРНК к месту репликации, трансляции мРНК и регуляции экспрессии генов .
Структурные белки
VP1 располагается в ядре вирусной частицы и представляет собой фермент — РНК-полимеразу . В инфицированной клетке фермент осуществляет синтез мРНК для дальнейшего производства вирусных белков, а также синтез сегментов РНК вирусного генома для новых вирионов.
VP2 формирует ядро вируса и связывает вирусный геном .
VP3 также составляет ядро вириона и является ферментом . Данный фермент катализирует образование 5'-кэп во время процессинга пре-мРНК . Кэп стабилизирует вирусную мРНК, защищая её от утилизации нуклеазами .
VP4 расположен на поверхности вириона и выступает с неё в виде шипа . Он связывается с рецепторами на поверхности клеток и управляет внедрением вируса в клетку . Для того, чтобы вирус смог вызывать инфекцию, VP4 должен быть модифицирован находящимся в кишечнике ферментом трипсином в VP5* и VP8* . Именно VP4 определяет вирулентность вируса. VP4 используется для серотипической классификации ротавирусов наряду с VP7.
VP6 формирует толщу капсида. Этот белок крайне антигенен и может использоваться для определения вида ротавируса . Этот белок используется для определения инфекции, вызванной ротавирусом А, в лабораторных тестах .
VP7 — структурный гликопротеин , формирующий наружную поверхность вириона. Он определяет G-тип серологической классификации и вместе с VP4 участвует в формировании иммунитета к инфекции .
Неструктурные белки
NSP1 , продукт гена 5, является неструктурным РНК-связывающим белком . NSP1 также блокирует продукцию интерферона , части врождённой иммунной системы, защищающей клетки от вирусной инфекции. NSP1 вынуждает протеасомы к лизису ключевых сигнальных компонентов, необходимых для стимуляции продукции интерферона в заражённой клетке и для реакции на интерферон, секретируемый соседними клетками. Целями для протеолитической деградации становятся несколько регуляторных факторов интерферона .
NSP2 — РНК-связывающий белок, аккумулируется в цитоплазматических включениях ( вироплазмах ) и участвует в репликации генома .
NSP3 связывается с вирусной мРНК в заражённых клетках и отвечает за выключение синтеза клеточных белков . NSP3 инактивирует два фактора инициации трансляции , необходимые для синтеза белков из мРНК клетки-хозяина. Во-первых, NSP3 выталкивает поли(а)-связывающий белок (PABP) из фактора инициации трансляции . PABP необходим для эффективной трансляции транскриптов с 3'-хвостами , которые обнаруживаются у большинства транскриптов клетки-хозяина. Во-вторых, NSP3 инактивирует , стимулируя его фосфорилирование. В то же время эффективная трансляция вирусной мРНК не требует двух этих факторов, поскольку эта РНК не содержит 3'-концов.
NSP4 — вирусный , вызывающий диарею . Является первым обнаруженным вирусным энтеротоксином .
NSP5 кодируется сегментом 11 генома ротавируса А и в инфицированных вирусом клетках накапливается в вироплазмах .
NSP6 является белком, связывающим нуклеиновые кислоты , кодируется геном 11 по внефазовой открытой рамке считывания .
| Сегмент РНК (Ген) | Размер, спаренных оснований | Белок | Молекулярная масса, kDa | Положение | Копий на частицу | Функция |
|---|---|---|---|---|---|---|
| 1 | 3302 | VP1 | 125 | В вершинах ядра | <25 | РНК-зависимая РНК-полимераза |
| 2 | 2690 | VP2 | 102 | Формирует внутреннюю оболочку ядра | 120 | Стимулирует вирусную РНК-репликазу |
| 3 | 2591 | VP3 | 88 | В вершинах ядра | <25 | метилтрансфераза, мРНК-кэпирующий фермент |
| 4 | 2362 | VP4 | 87 | Шипы на поверхности капсида | 120 | Прикрепление к клетке, вирулентность |
| 5 | 1611 | NSP1 | 59 | Неструктурный белок | 0 | Связывание 5’РНК, блокирование продукции интерферона |
| 6 | 1356 | VP6 | 45 | Толща капсида (средний слой) | 780 | Структурная функция; видоспецифичный антиген |
| 7 | 1104 | NSP3 | 37 | Неструктурный белок | 0 | Усиливает активность вирусной мРНК, выключает синтез клеточных белков |
| 8 | 1059 | NSP2 | 35 | Неструктурный белок | 0 | НТФаза, участвует в упаковке РНК |
| 9 | 1062 | VP7 1 VP7 2 | 38 и 34 | На поверхности | 780 | Структурный белок; нейтрализирующий антиген |
| 10 | 751 | NSP4 | 20 | Неструктурный белок | 0 | Энтеротоксин |
| 11 | 667 | NSP5 NSP6 | 22 | Неструктурный белок | 0 | оцРНК- и дцРНК-связывающий модулятор активности NSP2, фосфопротеин |
Таблица составлена на основе штамма обезьяньего ротавируса SA11 . Размеры генов у некоторых других штаммов могут отличаться.
Репликация

Ротавирусы реплицируются главным образом в кишечнике и заражают энтероциты ворсинок тонкого кишечника, что приводит к структурным и функциональным изменениям эпителия . Тройная белковая оболочка делает их устойчивыми к кислой среде желудка и пищеварительным ферментам в кишечнике.
Существует два возможных пути проникновения вируса в клетку: прямая пенетрация через клеточную мембрану и эндоцитоз. Предполагается, что трансмембранное проникновение опосредовано гидрофобной областью VP5, являющегося продуктом расщепления VP4. Эта область закрыта у нерасщеплённого VP4, поэтому вирионы с белковыми шипами, не подвергшимися расщеплению, не способны проникнуть в клетку этим способом. Второй путь проникновения — эндоцитоз. Вирус проникает в клетку путём опосредованного рецепторами эндоцитоза и образует везикулы, известные как эндосомы . Белки в третьем слое (VP7 и шип VP4) нарушают мембрану эндосомы, создав разницу в концентрации кальция. Это вызывает распад VP7-тримеров на одиночные белковые субъединицы, при этом оставшиеся вокруг вирусной двунитевой РНК белки VP2 и VP6 образуют двухслойную частицу (DLP) .
Одиннадцать дцРНК-нитей остаются под защитой двух белковых оболочек, где вирусная РНК-зависимая РНК-полимераза создаёт транскрипты мРНК вирусного генома. Оставаясь в ядре вириона, вирусная РНК избегает врождённого иммунного ответа, называемого РНК-интерференцией и вызываемого присутствием двухцепочечной РНК.
Во время инфекции ротавирус производит мРНК для биосинтеза белка и репликации генов. Большинство ротавирусных белков накапливается в вироплазмах, где реплицируется РНК и собираются DLP. Вироплазмы формируются вокруг ядра клетки уже через два часа после начала вирусной инфекции и состоят из вирусных фабрик, создаваемых, как предполагается, двумя вирусными неструктурными белками: NSP5 и NSP2. Ингибирование NSP5 РНК-интерференцией приводит к резкому снижению репликации ротавирусов. DLP мигрируют в эндоплазматический ретикулум , где они получают свой третий, внешний, слой (образованный VP7 и VP4). Потомство вируса высвобождается из клетки путём лизиса .
Передача
Ротавирусы передаются фекально-оральным путем, при контакте с загрязненными руками, поверхностями и предметами и, возможно, дыхательным путем . Вирусная диарея очень заразна. Фекалии инфицированного человека могут содержать более 10 триллионов инфекционных частиц на грамм ; для передачи инфекции другому человеку требуется менее 100 из них .
Ротавирусы стабильны в окружающей среде и были обнаружены в образцах устья реки в количестве до 1-5 инфекционных частиц на галлон США. Вирусы выживают от 9 до 19 дней . Санитарные меры, достаточные для уничтожения бактерий и паразитов, по-видимому, неэффективны в борьбе с ротавирусом, поскольку заболеваемость ротавирусной инфекцией в странах с высокими и низкими стандартами здравоохранения одинакова .
Признаки и симптомы
Ротавирусный энтерит — это заболевание от легкой до тяжелой степени, характеризующееся тошнотой, рвотой, водянистой диареей и субфебрильной температурой. Как только ребёнок заражается вирусом, проходит инкубационный период продолжительностью около двух дней, прежде чем появляются симптомы. Период болезни острый. Симптомы часто начинаются с рвоты, за которой следует от четырёх до восьми дней обильной диареи. Обезвоживание чаще встречается при ротавирусной инфекции, чем при большинстве случаев, вызванных бактериальными патогенами, и является наиболее частой причиной смерти, связанной с ротавирусной инфекцией .
Ротавирусные инфекции А могут возникать на протяжении всей жизни: первая обычно вызывает симптомы, но последующие инфекции обычно протекают в легкой или бессимптомной форме , поскольку иммунная система обеспечивает некоторую защиту . Следовательно, частота симптоматических инфекций наиболее высока у детей в возрасте до двух лет и постепенно снижается к 45 годам . Наиболее тяжелые симптомы, как правило, возникают у детей в возрасте от шести месяцев до двух лет, пожилых людей и людей с иммунодефицитом. Из-за иммунитета, приобретенного в детстве, большинство взрослых не восприимчивы к ротавирусу; у гастроэнтерита у взрослых обычно есть причина, отличная от ротавирусной, но бессимптомные инфекции у взрослых могут поддерживать передачу инфекции в сообществе . Есть некоторые свидетельства того, что группа крови может влиять на восприимчивость к заражению ротавирусами .
Механизмы заболевания
Ротавирусы размножаются в основном в кишечнике и поражают энтероциты ворсинок тонкой кишки, что приводит к структурным и функциональным изменениям эпителия . У людей, и особенно на животных моделях, имеются доказательства внекишечного распространения инфекционного вируса в другие органы и макрофаги .
Диарея вызывается множественной активностью вируса . Нарушение всасывания происходит из-за разрушения клеток кишечника, называемых энтероцитами. Токсичный белок ротавируса NSP4 индуцирует возрастную и кальций-зависимую секрецию хлорида, нарушает реабсорбцию воды, опосредованную транспортером SGLT1 (котранспортер натрия / глюкозы 2), по-видимому, снижает активность дисахаридаз мембран щеточной каймы и активирует кальций-зависимые секреторные рефлексы кишечной нервной системы . Повышенная концентрация ионов кальция в цитозоле (которые необходимы для сборки вирусов-потомков) достигается за счет NSP4, действующего как виропорин. Это увеличение ионов кальция приводит к аутофагии (саморазрушению) инфицированных энтероцитов .
NSP4 также секретируется. Эта внеклеточная форма, которая модифицируется ферментами протеазы в кишечнике, представляет собой энтеротоксин, который действует на неинфицированные клетки через рецепторы интегрина, что, в свою очередь, вызывает и увеличивает внутриклеточную концентрацию ионов кальция, секреторную диарею и аутофагию .
Рвота, характерная для ротавирусного энтерита, вызывается вирусом, поражающим энтерохромаффинные клетки на слизистой оболочке пищеварительного тракта. Инфекция стимулирует выработку 5'-гидрокситриптамина (серотонина). Это активирует блуждающие афферентные нервы, которые, в свою очередь, активируют клетки ствола головного мозга, которые контролируют рвотный рефлекс .
Здоровые энтероциты выделяют лактазу в тонкий кишечник; непереносимость молока из-за дефицита лактазы является симптомом ротавирусной инфекции , которая может сохраняться неделями . Повторение легкой диареи часто следует за повторным введением молока в рацион ребёнка из-за бактериальной ферментации дисахарида лактозы в кишечнике .
Иммунные реакции
Конкретные ответы
Ротавирусы вызывают как В-, так и Т-клеточный иммунный ответ. Антитела к белкам ротавируса VP4 и VP7 нейтрализуют вирусную инфекционность in vitro и in vivo . Вырабатываются специфические антитела классов IgM, IgA и IgG, которые, как было показано, защищают от ротавирусной инфекции путем пассивного переноса антител у других животных . Материнский трансплацентарный IgG может играть определённую роль в защите новорожденных от ротавирусных инфекций, но, с другой стороны, может снизить эффективность вакцины .
Врожденные реакции
После заражения ротавирусами возникает быстрый врожденный иммунный ответ, включающий интерфероны I и III типов и другие цитокины (в частности, Th1 и Th2 ), которые ингибируют репликацию вируса и рекрутируют макрофаги и естественные клетки-киллеры в инфицированные ротавирусом клетки . Ротавирусная дцРНК активирует рецепторы распознавания образов, такие как toll-подобные рецепторы , которые стимулируют выработку интерферонов. Ротавирусный белок NSP1 противодействует эффектам интерферонов 1-го типа, подавляя активность регуляторных белков интерферона IRF3, IRF5 и IRF7 .
Маркеры защиты
Уровни IgG и IgA в крови и IgA в кишечнике коррелируют с защитой от инфекции . Было заявлено, что специфичные для ротавируса сывороточные IgG и IgA в высоких титрах (например, > 1: 200) являются защитными, и существует значительная корреляция между титрами IgA и эффективностью ротавирусной вакцины .
Диагностика и выявление
Диагноз заражения ротавирусом обычно следует за диагнозом гастроэнтерита как причины тяжелой диареи. Большинство детей, поступивших в больницу с гастроэнтеритом, проходят тестирование на ротавирус А . Специфический диагноз заражения ротавирусом А ставится путем обнаружения вируса в кале ребёнка методом иммуноферментного анализа. На рынке имеется несколько лицензированных тест-наборов, которые являются чувствительными, специфичными и обнаруживают все серотипы ротавируса A . Другие методы, такие как электронная микроскопия и ПЦР (полимеразная цепная реакция), используются в исследовательских лабораториях . Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР) позволяет обнаруживать и идентифицировать все виды и серотипы ротавирусов человека .
Лечение и прогноз
Лечение острой ротавирусной инфекции неспецифично и включает в себя лечение симптомов и, что наиболее важно, лечение обезвоживания . При отсутствии лечения дети могут умереть от возникающего в результате сильного обезвоживания . В зависимости от тяжести диареи лечение состоит из пероральной регидратационной терапии, во время которой ребёнку дают дополнительную воду для питья, содержащую определённое количество соли и сахара . В 2004 году Всемирная организация здравоохранения (ВОЗ) и ЮНИСЕФ рекомендовали использовать раствор для пероральной регидратации с низкой осмолярностью и прием добавок цинка как двустороннее средство лечения острой диареи . Некоторые инфекции достаточно серьёзны, чтобы потребовать госпитализации, при которой вводятся жидкости путем внутривенной терапии или назогастральной интубации, а также контролируется уровень электролитов и сахара в крови ребёнка . Ротавирусные инфекции редко вызывают другие осложнения, и для хорошо обследованного ребёнка прогноз отличный . Было показано, что пробиотики сокращают продолжительность ротавирусной диареи , и согласно Европейскому обществу детской гастроэнтерологии «эффективные вмешательства включают введение специфических пробиотиков, таких как Lactobacillus rhamnosus или Saccharomyces boulardii , диосмектит или рацекадотрил» .
См. также
Примечания
- (англ.) на сайте Международного комитета по таксономии вирусов (ICTV) .
- ↑ (англ.) на сайте Международного комитета по таксономии вирусов (ICTV) . (Дата обращения: 19 ноября 2021) .
- Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева , А. С. Быкова . — М. : Медицинское информационное агентство, 2003. — С. 117. — ISBN 5-89481-136-8 .
- Грачева Н. М., Аваков А. А., Блохина Т. А., Щербаков И. Т. // . — 1998. — № 3 . — ISSN . 28 декабря 2014 года.
- ↑ Kirkwood C. D. Genetic and antigenic diversity of human rotaviruses: potential impact on vaccination programs (англ.) // The Journal of Infectious Diseases : journal. — 2010. — September ( vol. 202 , no. Suppl ). — P. S43—S48 . — doi : . — .
- O'Ryan M. The ever-changing landscape of rotavirus serotypes (неопр.) // The Pediatric Infectious Disease Journal. — 2009. — March ( т. 28 , № 3 Suppl ). — С. S60—S62 . — doi : . — .
- Patton J.T. (англ.) // Discovery Medicine : journal. — 2012. — January ( vol. 13 , no. 68 ). — P. 85—97 . — . 23 сентября 2015 года.
- Desselberger U., Wolleswinkel-van den Bosch J., Mrukowicz J., Rodrigo C., Giaquinto C., Vesikari T. (англ.) // Pediatr. Infect. Dis. J. : journal. — 2006. — Vol. 25 , no. 1 Suppl. . — P. S30—S41 . — doi : . — . 11 мая 2013 года.
- Desselberger, U.; Gray, James. Rotaviruses: methods and protocols (англ.) / Desselberger, U.; Gray, James. — Totowa, N. J.: , 2000. — P. 2. — ISBN 0-89603-736-3 .
- Carter J., & Saunders V. A. (2007). Virology: principles and applications. John Wiley & Sons; 148—151.
- ↑ Pesavento J. B., Crawford S. E., Estes M. K., Prasad B. V. Rotavirus proteins: structure and assembly (англ.) // Curr. Top. Microbiol. Immunol.. — 2006. — Vol. 309 . — P. 189—219 . — doi : . — .
- Prasad B. V., Chiu W. Structure of rotavirus (англ.) // Curr. Top. Microbiol. Immunol.. — 1994. — Vol. 185 . — P. 9—29 . — .
- Patton J. T. (англ.) // : journal. — , 1995. — Vol. 76 , no. 11 . — P. 2633—2644 . — doi : . — . 9 декабря 2012 года.
- Patton J. T. Rotavirus RNA replication and gene expression (неопр.) // Novartis Found. Symp.. — 2001. — Т. 238 . — С. 64—77; discussion 77—81 . — doi : . — .
- Vásquez-del Carpió R., Morales J. L., Barro M., Ricardo A., Spencer E. (англ.) // Biol. Res. : journal. — 2006. — Vol. 39 , no. 4 . — P. 649—659 . — doi : . — . 1 декабря 2017 года.
- Arnoldi F., Campagna M., Eichwald C., Desselberger U., Burrone O. R. (англ.) // J. Virol. : journal. — 2007. — Vol. 81 , no. 5 . — P. 2128—2137 . — doi : . — . — PMC . 28 сентября 2011 года.
- Angel J., Franco M. A., Greenberg H. B. (англ.) / Mahy B. W. J., Van Regenmortel M. H. V.. — Boston: Academic Press , 2009. — P. . — ISBN 0-12-375147-0 .
- Cowling V. H. Regulation of mRNA cap methylation (англ.) // Biochem. J.. — 2010. — January ( vol. 425 , no. 2 ). — P. 295—302 . — doi : . — . — PMC .
- Gardet A., Breton M., Fontanges P., Trugnan G., Chwetzoff S. (англ.) // J. Virol. : journal. — 2006. — Vol. 80 , no. 8 . — P. 3947—3956 . — doi : . — . — PMC . 28 сентября 2011 года.
- Arias C. F., Isa P., Guerrero C. A., Méndez E., Zárate S., López T., Espinosa R., Romero P., López S. Molecular biology of rotavirus cell entry (неопр.) // Arch. Med. Res.. — 2002. — Т. 33 , № 4 . — С. 356—361 . — doi : . — .
- ↑ Jayaram H., Estes M. K., Prasad B. V. Emerging themes in rotavirus cell entry, genome organization, transcription and replication (англ.) // Virus Research : journal. — 2004. — April ( vol. 101 , no. 1 ). — P. 67—81 . — doi : . — .
- Bishop R. F. Natural history of human rotavirus infection (англ.) // Arch. Virol. Suppl.. — 1996. — Vol. 12 . — P. 119—128 . — .
- Beards G. M., Campbell A. D., Cottrell N. R., Peiris J. S., Rees N., Sanders R. C., Shirley J. A., Wood H. C., Flewett T. H. (англ.) // J. Clin. Microbiol. : journal. — 1984. — 1 February ( vol. 19 , no. 2 ). — P. 248—254 . — . — PMC . 27 сентября 2011 года.
- Hua J., Mansell E. A., Patton J. T. Comparative analysis of the rotavirus NS53 gene: conservation of basic and cysteine-rich regions in the protein and possible stem-loop structures in the RNA (англ.) // Virology : journal. — 1993. — Vol. 196 , no. 1 . — P. 372—378 . — doi : . — .
- Arnold M.M. The Rotavirus Interferon Antagonist NSP1: Many Targets, Many Questions (англ.) // Journal of Virology : journal. — 2016. — Vol. 90 , no. 11 . — P. 5212—5215 . — doi : . — .
- Kattoura M. D., Chen X., Patton J. T. The rotavirus RNA-binding protein NS35 (NSP2) forms 10S multimers and interacts with the viral RNA polymerase (англ.) // Virology : journal. — 1994. — Vol. 202 , no. 2 . — P. 803—813 . — doi : . — .
- Taraporewala Z. F., Patton J. T. Nonstructural proteins involved in genome packaging and replication of rotaviruses and other members of the Reoviridae (англ.) // Virus Res. : journal. — 2004. — Vol. 101 , no. 1 . — P. 57—66 . — doi : . — .
- Poncet D., Aponte C., Cohen J. (англ.) // J. Virol. : journal. — 1993. — 1 June ( vol. 67 , no. 6 ). — P. 3159—3165 . — . — PMC . 28 сентября 2011 года.
- López, S; Arias, C.F. Rotavirus-host cell interactions: an arms race (англ.) // Current Opinion in Virology. — Elsevier , 2012. — August ( vol. 2 , no. 4 ). — P. 389—398 . — doi : . — .
- Hyser J. M., Estes M. K. (англ.) // Current Opinion in Gastroenterology. — , 2009. — January ( vol. 25 , no. 1 ). — P. 36—43 . — doi : . — . — PMC . 11 мая 2013 года.
- Afrikanova I., Miozzo M. C., Giambiagi S., Burrone O. (англ.) // : journal. — , 1996. — Vol. 77 , no. 9 . — P. 2059—2065 . — doi : . — . 26 мая 2012 года.
- Rainsford E. W., McCrae M. A. Characterization of the NSP6 protein product of rotavirus gene 11 (англ.) // Virus Res. : journal. — 2007. — Vol. 130 , no. 1—2 . — P. 193—201 . — doi : . — .
- Mohan K. V., Atreya C. D. Nucleotide sequence analysis of rotavirus gene 11 from two tissue culture-adapted ATCC strains, RRV and Wa (англ.) // Virus Genes : journal. — 2001. — Vol. 23 , no. 3 . — P. 321—329 . — doi : . — .
- Desselberger U. Rotavirus: basic facts. In Rotaviruses Methods and Protocols . Ed. Gray, J. and Desselberger U. Humana Press, 2000, pp. 1—8. ISBN 0-89603-736-3
- Patton J. T. Rotavirus RNA replication and gene expression. In Novartis Foundation. Gastroenteritis Viruses , Humana Press, 2001, pp. 64—81. ISBN 0-471-49663-4
- Claude M. Fauquet; J. Maniloff; Desselberger, U. Virus taxonomy: classification and nomenclature of viruses: 8th report of the International Committee on Taxonomy of Viruses (англ.) . — Amsterdam: Elsevier/Academic Press, 2005. — P. 489. — ISBN 0-12-249951-4 .
- Greenberg H. B., Estes M. K. (неопр.) // Gastroenterology. — 2009. — May ( т. 136 , № 6 ). — С. 1939—1951 . — doi : . — .
- Greenberg H. B., Clark H. F., Offit P. A. Rotavirus pathology and pathophysiology (англ.) // Curr. Top. Microbiol. Immunol.. — 1994. — Vol. 185 . — P. 255—283 . — .
- Baker M., Prasad B. V. Rotavirus cell entry (англ.) // Current Topics in Microbiology and Immunology. — 2010. — Vol. 343 . — P. 121—148 . — doi : . — .
- Patton J. T., Vasquez-Del Carpio R., Spencer E. Replication and transcription of the rotavirus genome (англ.) // Curr. Pharm. Des. : journal. — 2004. — Vol. 10 , no. 30 . — P. 3769—3777 . — doi : . — .
- Ruiz M. C., Leon T., Diaz Y., Michelangeli F. Molecular biology of rotavirus entry and replication (англ.) // TheScientificWorldJournal : journal. — 2009. — Vol. 9 . — P. 1476—1497 . — doi : . — .
- Butz AM, Fosarelli P, Dick J, Cusack T, Yolken R (1993). . Pediatrics . 92 (2): 202—205. doi : . PMID . S2CID .
- ↑ Dennehy PH (2000). "Transmission of rotavirus and other enteric pathogens in the home". Pediatric Infectious Disease Journal . 19 (Suppl 10): S103—105. doi : . PMID . S2CID .
- ↑ Bishop RF. Natural history of human rotavirus infection // Viral Gastroenteritis. — 1996. — Vol. 12. — P. 119–128. — ISBN 978-3-211-82875-5 . — doi : .
- Grimwood K, Lambert SB (2009). . Human Vaccines . 5 (2): 57—69. doi : . PMID . S2CID . из оригинала 15 сентября 2019 . Дата обращения: 17 сентября 2022 .
- Rao VC, Seidel KM, Goyal SM, Metcalf TG, Melnick JL (1984). (PDF) . Applied and Environmental Microbiology . 48 (2): 404—409. Bibcode : . doi : . PMC . PMID . из оригинала 27 сентября 2011 . Дата обращения: 17 сентября 2022 .
- Maldonado YA, Yolken RH (1990). "Rotavirus". Baillière's Clinical Gastroenterology . 4 (3): 609—625. doi : . PMID .
- Glass RI, Parashar UD, Bresee JS, Turcios R, Fischer TK, Widdowson MA, Jiang B, Gentsch JR (2006). "Rotavirus vaccines: current prospects and future challenges". The Lancet . 368 (9532): 323—332. doi : . PMID . S2CID .
- Offit PA. Gastroenteritis viruses. — New York : Wiley, 2001. — P. 106–124. — ISBN 978-0-471-49663-2 .
- Epidemiology of Group A Rotaviruses: Surveillance and Burden of Disease Studies // Rotaviruses: Methods and Protocols. — Totowa, NJ : Humana Press, 2000. — Vol. 34. — P. 217–238. — ISBN 978-0-89603-736-6 . — doi : .
- Anderson EJ, Weber SG (2004). . The Lancet Infectious Diseases . 4 (2): 91—99. doi : . PMC . PMID .
- Elhabyan A, Elyaacoub S, Sanad E, Abukhadra A, Elhabyan A, Dinu V (November 2020). . Virus Research . 289 : 198163. doi : . PMC . PMID .
- Greenberg HB, Estes MK (2009). . Gastroenterology . 136 (6): 1939—1951. doi : . PMC . PMID .
- Rotavirus pathology and pathophysiology // Rotaviruses. — New York : Springer, 1994. — Vol. 185. — P. 255–283. — ISBN 9783540567615 . — doi : .
- Crawford SE, Patel DG, Cheng E, Berkova Z, Hyser JM, Ciarlet M, Finegold MJ, Conner ME, Estes MK (2006). . Journal of Virology . 80 (10): 4820—4832. doi : . PMC . PMID .
- Ramig RF (2004). . Journal of Virology . 78 (19): 10213—10220. doi : . PMC . PMID .
- Hyser JM, Estes MK (2009). . Current Opinion in Gastroenterology . 25 (1): 36—43. doi : . PMC . PMID .
- Hyser JM, Collinson-Pautz MR, Utama B, Estes MK (2010). . mBio . 1 (5). doi : . PMC . PMID .
- Berkova Z, Crawford SE, Trugnan G, Yoshimori T, Morris AP, Estes MK (2006). . Journal of Virology . 80 (12): 6061—6071. doi : . PMC . PMID .
- Hagbom M, Sharma S, Lundgren O, Svensson L (2012). "Towards a human rotavirus disease model". Current Opinion in Virology . 2 (4): 408—418. doi : . PMID .
- Farnworth ER (2008). . The Journal of Nutrition . 138 (6): 1250S—1254S. doi : . PMID .
- Ouwehand A, Vesterlund S (2003). "Health aspects of probiotics". IDrugs: The Investigational Drugs Journal . 6 (6): 573—580. PMID .
- Arya SC (1984). . Journal of Infectious Diseases . 150 (5): 791. doi : . PMID .
- Ward R (2009). "Mechanisms of protection against rotavirus infection and disease". The Pediatric Infectious Disease Journal . 28 (Suppl 3): S57—S59. doi : . PMID .
- Vega CG, Bok M, Vlasova AN, Chattha KS, Fernández FM, Wigdorovitz A, Parreño VG, Saif LJ (2012). . PLOS ONE . 7 (8): e42788. Bibcode : . doi : . PMC . PMID .
- Mwila K, Chilengi R, Simuyandi M, Permar SR, Becker-Dreps S (2017). . Clinical and Vaccine Immunology . 24 (1). doi : . PMC . PMID .
- Gandhi GR, Santos VS, Denadai M, da Silva Calisto VK, de Souza Siqueira Quintans J, de Oliveira e Silva AM, de Souza Araújo AA, Narain N, Cuevas LE, Júnior LJ, Gurgel RQ (2017). . Cytokine . 96 : 152—160. doi : . PMID . S2CID . из оригинала 6 августа 2020 . Дата обращения: 17 сентября 2022 .
- Holloway G, Coulson BS (2013). . The Journal of General Virology . 94 (6): 1151—1160. doi : . PMID .
- ↑ Villena J, Vizoso-Pinto MG, Kitazawa H (2016). . Frontiers in Immunology . 7 : 563. doi : . PMC . PMID .
- Rotaviruses: immunological determinants of protection against infection and disease // Advances in Virus Research Volume 44. — 1994. — Vol. 44. — P. 161–202. — ISBN 9780120398447 . — doi : .
- Patel M, Glass RI, Jiang B, Santosham M, Lopman B, Parashar U (2013). . The Journal of Infectious Diseases . 208 (2): 284—294. doi : . PMID .
- ↑ Patel MM, Tate JE, Selvarangan R, Daskalaki I, Jackson MA, Curns AT, Coffin S, Watson B, Hodinka R, Glass RI, Parashar UD (2007). . The Pediatric Infectious Disease Journal . 26 (10): 914—919. doi : . PMID . S2CID .
- The Pediatric ROTavirus European CommitTee (PROTECT) (2006). . Epidemiology and Infection . 134 (5): 908—916. doi : . PMC . PMID .
- Desk Encyclopedia of Human and Medical Virology. — Boston : Academic Press, 2009. — P. 278. — ISBN 978-0-12-375147-8 .
- Gastroenteritis viruses. — New York : Wiley, 2001. — P. 14. — ISBN 978-0-471-49663-2 .
- Fischer TK, Gentsch JR (2004). . Reviews in Medical Virology . 14 (2): 71—82. doi : . PMC . PMID . из оригинала 21 апреля 2022 . Дата обращения: 17 сентября 2022 .
- Diggle L (2007). "Rotavirus diarrhea and future prospects for prevention". British Journal of Nursing . 16 (16): 970—974. doi : . PMID .
- Alam NH, Ashraf H (2003). "Treatment of infectious diarrhea in children". Paediatric Drugs . 5 (3): 151—165. doi : . PMID . S2CID .
- Sachdev HP (1996). "Oral rehydration therapy". Journal of the Indian Medical Association . 94 (8): 298—305. PMID .
- World Health Organization, UNICEF. . Дата обращения: 3 мая 2012. 25 апреля 2012 года.
- Ramig RF (2007). "Systemic rotavirus infection". Expert Review of Anti-infective Therapy . 5 (4): 591—612. doi : . PMID . S2CID .
- Ahmadi E, Alizadeh-Navaei R, Rezai MS (2015). . Caspian Journal of Internal Medicine . 6 (4): 187—195. PMC . PMID .
- Guarino A, Ashkenazi S, Gendrel D, Lo Vecchio A, Shamir R, Szajewska H (2014). "European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014". Journal of Pediatric Gastroenterology and Nutrition . 59 (1): 132—152. doi : . PMID . S2CID .
- 2021-04-14
- 1