Interested Article - Субарахноидальное кровоизлияние

- 2020-12-31
- 1
Субарахноидальное кровоизлияние (САК) — кровоизлияние в субарахноидальное пространство (полость между паутинной и мягкой мозговыми оболочками). Может произойти спонтанно, обычно вследствие разрыва артериальной аневризмы , или в результате черепно-мозговой травмы .
Признаки САК возникают внезапно, без предвестников: начинается резкая головная боль (напоминающая «удар по голове»), тошнота , повторная рвота , часто наступает утрата сознания . Характерно психомоторное возбуждение . Диагноз обычно подтверждается методом компьютерной томографии и, в некоторых случаях, люмбальной пункцией . Лечение субарахноидального кровоизлияния из аневризмы хирургическое, возможно применение методов интервенционной радиологии и терапевтические пособия, направленные на предотвращение рецидива кровоизлияния и снижение риска его осложнений . C 1930-х годов применяется краниотомия с клипированием шейки аневризмы, с 1990-х годов внедряется менее травматичная операция — эндоваскулярная установка микроспирали или баллона под контролем ангиографии .
САК — одна из форм острого нарушения мозгового кровообращения (ОНМК), и составляет от 1 % до 7 % случаев ОНМК. САК — угрожающее жизни состояние, которое может привести к тяжёлой инвалидизации пациента даже в случае ранней диагностики и адекватного лечения. До половины случаев САК заканчиваются летальным исходом, 10—15 % больных погибают ещё до поступления в стационар .
Эпидемиология
Частота спонтанного субарахноидального кровоизлияния в популяции составляет 8—12 на 100 тысяч человек в год .
Травматическое субарахноидальное кровоизлияние является наиболее частым видом внутричерепных кровоизлияний. Их частота при черепно-мозговой травме варьирует в широких пределах — от 8 до 59 % . Возраст пострадавших не является определяющим фактором, однако частота субарахноидальных кровоизлияний у пожилых людей увеличивается . Алкогольная интоксикация также способствует увеличению риска травматических субарахноидальных кровоизлияний .
Этиология

Субарахноидальное кровоизлияние бывает либо травматическим, либо нетравматическим (спонтанным).
Наиболее часто (85 % случаев) нетравматические субарахноидальные кровоизлияния связаны с разрывом аневризм артерий головного мозга, которые обычно располагаются в виллизиевом круге . За счёт недостаточности участка стенки артерии, происходит формирование выпячивания, имеющего мешотчатую форму — мешотчатой аневризмы. Чаще всего они формируются в местах отхождения артериальных сосудов, то есть в местах наибольшей турбулентности крови. Чаще наблюдается разрыв мелких аневризм, вместе с тем, более высокий риск разрыва имеют крупные аневризмы, которые встречаются реже .
В 15—20 % случаев спонтанных САК, аневризма при первой ангиографии не выявляется .
Приблизительно в половине из этих случаев отмечается перимезенцефальное кровоизлияние, при котором геморрагическое содержимое располагается в субарахноидальном пространстве в пределах среднего мозга. Источник кровоизлияния в этих случаях остаётся невыясненным. Также возможны кровоизлияния из-за других патологических изменений (артериовенозные мальформации, заболевания сосудов спинного мозга, кровоизлияние в опухоль) . В числе причин САК также кокаиновая наркомания , серповидно-клеточная анемия (обычно у детей); реже — приём антикоагулянтов , нарушения свёртывающей системы крови и гипофизарный инсульт .
Кровь в субарахноидальном пространстве может выявляться при КТ-исследовании у 60 % пациентов с травмой головного мозга Травматическое САК обычно наблюдается при переломе костей черепа или ушибе головного мозга Обычно этот вариант САК сочетается с другими повреждениями головного мозга, и является неблагоприятным прогностическим признаком. Однако, остаётся неясным, связан ли неблагоприятный прогноз непосредственно с фактом САК, или кровь в субарахноидальном пространстве — лишь косвенный индикатор тяжести травмы головы, а прогноз обусловлен некими сочетанными механизмами .
Патогенез травматического субарахноидального кровоизлияния
Травматическое САК рассматривают, как результат непосредственного повреждения сосудов, покрывающих на всём протяжении поверхность мозга. Излившаяся в субарахноидальное пространство кровь распространяется по ликворным пространствам .
Патогенез травматического САК и его клиническое течение отражает три стадии процесса :
- Излившаяся в субарахноидальное пространство кровь распространяется по системе ликвороносных каналов. Появление крови в субарахноидальном пространстве приводит к увеличению объёма ликвора с развитием внутричерепной гипертензии.
- Свёртывание крови в ликворе с образованием сгустков. Свёртки крови могут приводить к частичной или полной блокаде ликворных путей. Это приводит к дальнейшему нарушению ликвороциркуляции и нарастанию внутричерепной гипертензии.
- Лизис свёртков крови сопровождается развитием явлений асептического воспаления и появлением менингеального синдрома.
Симптоматика
Классическим симптомом субарахноидального кровоизлияния является остро возникшая резкая головная боль по типу «удара по голове» , часто с пульсацией в затылочной области . Приблизительно в трети случаев САК манифестирует только этим симптомом, в одном случае из десяти у пациентов, обратившихся за медицинской помощью с этим единственным симптомом, диагностируется САК . Может наблюдаться многократная рвота, в одном из 14 случаев развивается судорожный синдром Развивается нарушение сознания ( сопор , кома ), появляется менингеальная симптоматика . Ригидность затылочных мышц обычно возникает через 6 часов после начала САК . Вклинение мозга в большое затылочное отверстие в результате внутричерепной гипертензии может проявляться мидриазом и утратой фотореакции зрачков . В 3—13 % случаев наблюдается синдром Терсона — кровоизлияние в переднюю камеру глазного яблока , сетчатку, стекловидное тело .
Симптомы поражения глазодвигательного нерва (парез взора вверх и кнутри, птоз век , расходящееся косоглазие, двоение) могут свидетельствовать о кровоизлиянии из задней соединительной артерии . Судороги чаще встречаются при кровоизлиянии из артериальной аневризмы. Тем не менее, любая симптоматика не позволяет с точностью указать локализацию и источник кровотечения. Судорожный синдром в анамнезе позволяет предположить наличие артериовенозной мальформации .
В результате кровоизлияния, происходит повышение содержания в плазме крови адреналина и других веществ с адреналоподобным действием, что проявляется повышением артериального давления с сердечно-лёгочной недостаточностью ( отёк лёгких , аритмия , изменения на ЭКГ — в 27 % случаев) , в 3 % случаев вскоре после САК наступает остановка сердца .
Субарахноидальное кровоизлияние может возникнуть вследствие черепно-мозговой травмы. Симптомами являются головная боль, нарушение сознания и гемипарез . САК часто сопутствует черепно-мозговой травме, причём нарушение сознания на фоне САК является плохим прогностическим признаком . При аневризматическом субарахноидальном кровоизлиянии наблюдается необычайно сильная, молниеносно нарастающая цефалгия (головная боль).
Диагностика


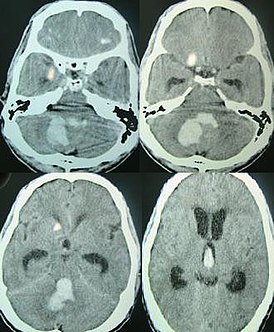
Диагностика САК начинается с анализа истории болезни и физикального осмотра пациента с целью обнаружения симптомов САК и дифференциальной диагностики с другими неврологическими заболеваниями. Окончательный диагноз ставится после проведения КТ-исследования , высокочувствительного к САК и помогающего выявить его в 95 % случаев. Через несколько дней после состоявшегося САК более чувствителен метод МРТ .
Люмбальная пункция , при которой с помощью иглы забирается на анализ спинномозговая жидкость , обнаруживает признаки САК в 3 % случаев с нормальной КТ-картиной. В связи с этим, люмбальная пункция показана пациентам с отрицательным результатом на КТ у пациентов с клинической картиной САК . При люмбальной пункции на анализ берутся три пробы ликвора . О субарахноидальном кровоизлиянии можно утверждать, если повышение содержания эритроцитов выявляется одинаково во всех трёх пробирках. Если количество эритроцитов снижается от пробирки к пробирке, более вероятно, что кровь в ликворе связана с травмированием мелких сосудов в результате пункции (так называемая «путевая кровь») . Ликвор также исследуется на наличие билирубина (продукта распада гемоглобина ) — оценивается ксантохромия (пожелтение после центрифугирования); для более объективной оценки применяется спектрофотометрия . Ксантохромия и спектрофотометрия остаются надёжными способами выявления САК спустя несколько дней после начала головной боли . Для использования этих методов необходим интервал в 12 часов от начала САК, которые требуются для распада гемоглобина .
Поскольку САК обнаруживается лишь в 10 % случаев с типичной головной болью, необходим дифференциальный диагноз с менингитом , мигренью и тромбозом венозных синусов . Внутримозговое кровоизлияние, при котором кровь поступает непосредственно в вещество головного мозга ( геморрагический инсульт ), встречается в два раза чаще, чем субарахноидальное кровоизлияние, и часто ошибочно принимается за него . Достаточно распространены случаи, когда САК ошибочно диагностируется как мигрень или головная боль напряжения, в связи с чем своевременно не выполняется КТ. В 2004 году такие ошибки наблюдались в 12 % случаев, чаще при небольших кровоизлияниях с отсутствием нарушения сознания. Задержка с правильной диагностикой приводила к ухудшению состояния больных . В некоторых случаях головная боль регрессирует самостоятельно, и никаких иных симптомов не наблюдается. Этот тип головной боли называется «сторожевой головной болью», поскольку указывает на небольшой кровоподтёк («сторожевой кровоподтёк») из аневризмы. Сторожевая головная боль требует проведения КТ и люмбальной пункции, так как в течение трёх недель возможно повторное кровоизлияние .
После верификации диагноза субарахноидального кровоизлияния, необходимо выявить его источник. При подозрении на разрыв артериальной аневризмы, необходима её визуализация методом ангиографии сосудов головного мозга (который позволяет осуществить одновременное эндоваскулярное хирургическое вмешательство) или КТ-ангиографии .
Классификация
Существует несколько градационных шкал для оценки САК. Для оценки тяжести состояния пациента используются шкалы, подобные шкале комы Глазго . Распространены три специализированных метода оценки; в каждом количество баллов отражает тяжесть состояния . Эти шкалы были предложены при ретроспективном анализе состояния пациентов и исходов заболевания.
Первая шкала тяжести состояния была предложена Хантом и Хессом в 1968 :
| Уровень | Знаки и симптомы | Выживаемость |
|---|---|---|
| 1 | Бессимптомное течение или минимальная головная боль и лёгкая ригидность затылочных мышц | 70 % |
| 2 | Головная боль средняя или сильная; ригидность затылочных мышц; неврологический дефицит — только парез черепных нервов | 60 % |
| 3 | Оглушение; минимальный неврологический дефицит | 50 % |
| 4 | Сопор; средний или тяжёлый гемипарез; возможны начальные признаки децеребрационной ригидности и вегетативные нарушения | 20 % |
| 5 | Глубокая кома; децеребрационная ригидность; агония | 10 % |
Шкала Фишера использует классификацию, основанную на визуализации САК при компьютерной томографии . Эта шкала была модифицирована Клаассеном с соавторами с учётом объёма кровоизлияния и наличия крови в желудочках головного мозга .
| Уровень | Визуализация кровоизлияния |
|---|---|
| 1 | Не визуализируется |
| 2 | Толщина менее 1 мм |
| 3 | Толщина более 1 мм |
| 4 | Любая толщина со внутрижелудочковым кровоизлиянием или распространением на паренхиму головного мозга |
Классификация Всемирной федерации нейрохирургов для оценки тяжести САК использует шкалу комы Глазго (ШКГ) и очагового неврологического дефицита .
| Уровень | ШКГ | Очаговый неврологический дефицит |
|---|---|---|
| 1 | 15 | Отсутствует |
| 2 | 13-14 | Отсутствует |
| 3 | 13-14 | Имеется |
| 4 | 7-12 | Имеется или отсутствует |
| 5 | <7 | Имеется или отсутствует |
Обобщающая классификационная шкала для оценки прогноза САК была предложена Огилви и Картером . Шкала учитывает пять факторов, следует отмечать наличие или отсутствие признака: возраст старше 50; 4 или 5 баллов по шкале Хесса и Ханта; 3 или 4 балла по шкале Фишера; размер аневризмы больше 10 мм; аневризма задней циркуляторной (вертебро-базилярной) системы размером 25 мм и более .
Лечение
Тактика ведения больных включает меры, направленные на стабилизацию состояния пациента — гемостатическая терапия и устранение источника кровотечения, предупреждение развития осложнений и рецидива САК .
Общие меры
Приоритетной задачей является стабилизация состояния пациента. Пациентам с нарушениями сознания возможно проведение интубации трахеи и подключение к аппарату ИВЛ. Необходим регулярный контроль пульса, артериального давления, периодическая оценка состояния пациента по шкале комы Глазго. После установки диагноза САК, предпочтительна госпитализация пациента в отделение интенсивной терапии, с учётом того, что в 15 % случаев возможно продолжившееся кровотечение.
Питание пациентов осуществляется посредством назо (оро)-гастрального зонда, более предпочтительно парентеральное питание. Обезболивание проводится препаратами с меньшим седативным эффектом с целью адекватного контроля за уровнем сознания. Для предотвращения тромбоза глубоких вен показано применение компрессионного трикотажа . Целесообразна катетеризация мочевого пузыря для контроля водного баланса . Возможно применение противорвотных средств .
Предотвращение повторного кровотечения

Пациентам, у которых при КТ-исследовании выявлено массивное кровоизлияние, наблюдается нарушение сознания или очаговая неврологическая симптоматика, целесообразно проведение экстренного хирургического вмешательства с целью удаления геморрагического содержимого или окклюзии источника кровотечения. Остальные пациенты ведутся более экстенсивно, им проводится ангиография или КТ-ангиография. Вместе с тем, трудно предсказать, у кого из пациентов возникнет повторное кровотечение, оно возможно в любое время и ухудшает прогноз. Спустя сутки после САК, риск повторного кровотечения сохраняется на уровне 40 % в течение последующих 4 недель. Таким образом, лечение должно быть направлено на скорейшее снижение этого риска .
В случае выявления артериальной аневризмы при ангиографии, возможны два пути предотвращения повторного кровотечения: клипирование и эндоваскулярная окклюзия . При клипировании осуществляется краниотомия, обнаруживается аневризма и на её шейку накладывается клипса. Эндоваскулярная окклюзия производится через крупные кровеносные сосуды: катетер вводится в бедренную артерию в паховой области, далее проводится в аорту и артерии, кровоснабжающие головной мозг (сонные и позвоночные). После обнаружения аневризмы, в неё вводится платиновое кольцо, способствующее образованию тромба и облитерации. Решение о выборе метода лечения совместно принимается нейрохирургом, нейрорадиологом и, зачастую, другими специалистами .
Принципиальными критериями выбора методики «выключения» аневризмы являются её локализация и размеры, а также состояние пациента. Эндовазальный доступ к аневризмам средней мозговой артерии и её ветвей затруднён, в связи с чем предпочтение отдаётся клипированию. Напротив, хирургический доступ более сложен к базилярной и задней мозговой артериям, поэтому предпочтительно применение эндовазальной техники . Эта тактика основана на общем хирургическом опыте; единственное рандомизированное контролируемое исследование по сопоставлению методов проводилось на группе относительно благополучных пациентов с небольшими (меньше 10 мм) аневризмами передней мозговой и передней соединительной артерий, а эта локализация встречается лишь в 20 % САК из артериальных аневризм . Это исследование, «Международное исследование по субарахноидальным аневризмам ( англ. ISAT )», показало, что риск смерти или снижения повседневной активности в результате эндовазального вмешательства был уменьшен на 7,4 % (абсолютный риск) и 23,5 % (относительный риск) . Главный недостаток эндоваскулярной облитерации — возможность последующего рецидива аневризмы, при хирургическом вмешательстве этот риск минимален. ISAT показало, что 8,3 % пациентов после эндоваскулярной облитерации в отдалённые сроки потребовалось повторное лечение. Следовательно, пациентам, перенёсшим это вмешательство, необходимо постоянное диспансерное наблюдение для исключения рецидива . При других исследованиях также отмечалась возможность рецидивов, требующих возобновления лечения .
Вазоспазм
Вазоспазм (спазм сосудов), приводящий к снижению кровотока — серьёзное осложнение САК. Вазоспазм может послужить причиной ишемического повреждения вещества головного мозга (так называемой «отсроченной ишемии»), в тяжёлых случаях приводящего к летальному исходу. Отсроченная ишемия проявляется появлением новой неврологической симптоматики, и может быть подтверждена транскраниальной допплерографией или ангиографией. Отсроченная ишемия наблюдается приблизительно у трети пациентов с САК, и в половине случаев приводит к необратимому неврологическому дефициту . Целесообразно динамическое наблюдение методом допплерографии каждые 24—48 часов; скорость кровотока, превышающая 120 см/сек, подозрительна на вазоспазм .
Симптоматический церебральный вазоспазм — это основная причина последующей инвалидизации и смертности у больных с разрывом аневризмы. Симптоматический спазм артерий мозга (церебральный вазоспазм) возникает примерно у 30 % больных. После разрыва аневризмы у больного идёт временный период улучшении или стабилизации состояния до момента возникновения у него симптоматического вазоспазма. Неврологические симптомы спазма артерий головного мозга возникают на 4—14-й день после первого разрыва аневризмы (чаще через 1 неделю с момента субарахноидального кровоизлияния). Повторное возникновение неврологических симптомов у пациента можно различить лишь в том случае, если уже до этого был выявлен неврологический дефицит и велось наблюдение за клиническими проявлениями у него. Возникшая неврологическая симптоматика соответствует ишемии мозга в специфических артериальных бассейнах. Выраженность спазма артерий мозга (церебрального вазоспазма) определяет степень вероятности развития инфаркта мозга .
Для предотвращения вазоспазма было предложено применение блокаторов кальциевых каналов, блокирующих поступление кальция в клетки гладкой мускулатуры . Пероральный блокатор кальциевых каналов нимодипин оказывает заметный эффект на 4—21 день после САК, даже если вазоспазм заметно не уменьшается при ангиографии . При травматическом САК, нимодипин не влияет на долгосрочный результат, в связи с чем не показан . Исследовалась возможность применения других блокаторов кальциевых каналов и сульфата магния, и в настоящее время их использование в терапии вазоспазма не рекомендовано; также нет данных, демонстрирующих лучший эффект от внутривенного применения нимодипина .
Если в результате терапии не удаётся достичь регрессии симптомов отсроченной ишемии, возможна попытка применения ангиографии с целью уточнения локализации вазоспазма и непосредственного введения вазодилататора (препарата, устраняющего спазм сосудистой стенки) непосредственно в артерию. Также возможно применение баллонной ангиопластики .
Другие осложнения
Гидроцефалия может осложнить САК как в ранние, так и в отдалённые сроки. Гидроцефалия диагностируется при КТ исследовании, проявляясь признаками расширения боковых желудочков. При нарушении сознания, удаление избыточного ликвора выполняется посредством терапевтической люмбальной пункции, экстравентрикулярного дренирования (временный дренаж, устанавливаемый в один из желудочков) или шунтирования . Регрессия гидроцефалии может значительно улучшить состояние пациента . Приблизительно у половины пациентов с САК отмечаются колебания артериального давления, электролитные нарушения, развивается пневмония, сердечная декомпенсация . Примерно в трети случаев у пациентов в период госпитализации отмечается судорожный синдром . Широко распространена точка зрения, что для его профилактики целесообразно применение противоэпилептических средств . Несмотря на распространённость такой лечебной тактики , не существует доказательных обоснований её применения . Некоторые исследования показали связь применения этих препаратов с неблагоприятным прогнозом; это объясняется либо нежелательными эффектами противосудорожных препаратов, либо их применением в более тяжёлых клинических ситуациях . САК также может осложниться желудочно-кишечным кровотечением, связанным с развитием стрессовой язвы .
Прогноз
Ближайшие последствия и смертность
САК часто сопряжено с неблагоприятным исходом . Смертность от САК составляет от 40 до 50 % , однако имеется тенденция к улучшению показателей выживаемости . У четверти пациентов, перенёсших госпитальный период, остаются существенные ограничения в образе жизни, менее чем у одной пятой пациентов заболевание оканчивается без всяких последствий . Задержка с диагностикой небольшого САК (диагностируемого вначале как мигрень) ухудшает исход заболевания . К факторам, ухудшающим исход заболевания, относят тяжёлые неврологические нарушения; систолическую гипертензию; инфаркт миокарда или САК в анамнезе; заболевания печени, большой объём кровоизлияния или большие размеры аневризмы при первичном КТ-исследовании; локализация аневризмы в заднем циркуляторном (вертебро-базилярном) бассейне; пожилой возраст . Факторы, влияющие на исход заболевания в период госпитализации — отсроченная ишемия в результате вазоспазма, развитие внутримозговой гематомы или внутрижелудочкового кровоизлияния, наличие лихорадки на восьмой день лечения .
Так называемое «ангиограммо-негативное» САК, то есть субарахноидальное кровоизлияние, при котором в ходе ангиографии не выявляется артериальной аневризмы, имеет лучший прогноз по сравнению с САК из аневризмы; тем не менее, существует риск ишемии, повторного кровотечения и гидроцефалии . Перимезенцефальное субарахноидальное кровоизлияние (то есть САК в пределах среднего мозга), однако, крайне редко сопровождается отсроченной ишемией или повторным кровотечением, и прогноз исхода этого кровоизлияния очень хороший .
Считается, что прогноз черепно-мозговой травмы (ЧМТ) зависит от локализации и объёма субарахноидального кровоизлияния . Затруднительно оценить вклад САК в общую картину черепно-мозговой травмы; неизвестно, ухудшает ли субарахноидальное кровоизлияние прогноз черепно-мозговой травмы, или оно является индикатором тяжести повреждения . У пациентов со среднетяжёлой или тяжёлой ЧМТ, которые госпитализируются с наличием САК, имеется двойной риск летального исхода по сравнению с пациентами, у которых САК отсутствует . У таких пациентов также имеется более высокий риск значительной инвалидизации и вегетативного состояния; травматическое САК коррелирует с другими индикаторами неблагоприятного исхода — травматической эпилепсией и гидроцефалией . Однако, более 90 % пациентов с травматическим САК, имеющие более 12 баллов по шкале комы Глазго, имеют хороший исход .
Существуют также скромные доказательства того, что генетические факторы влияют на прогноз при САК. Например, наличие двух копий ApoE4 (варианта гена, кодирующего аполипопротеин E , играющего роль в болезни Альцгеймера ), возможно, увеличивает риск отсроченной ишемии и ухудшает исход .
Отдалённые последствия
Нейрокогнитивные расстройства — утомляемость, изменение настроения и др. связанные симптомы — общие последствия САК. Даже у пациентов, имевших хорошее неврологическое восстановление, распространены беспокойство , депрессия , посттравматическое стрессовое расстройство и когнитивные нарушения; 46 % пациентов, перенёсших САК, имеют нарушения познавательной функции, снижающие качество жизни . Около 60 % жалуются на частые головные боли . САК из аневризмы может привести к повреждению гипоталамуса и гипофиза , играющих центральную роль в гормональной продукции и регуляции. У более четверти людей, перенёсших САК, развивается гипопитуитаризм (дефицит одного или нескольких гормонов гипоталамо-гипофизарной системы — соматотропина , фолликулостимулирующего , лютеинизирующего гормонов и др.) .
Примечания
- Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ van Gijn J., Kerr R.S., Rinkel G.J. Subarachnoid haemorrhage (англ.) // The Lancet . — Elsevier , 2007. — Vol. 369 , no. 9558 . — P. 306—318 . — doi : . — .
- ↑ Свистов Д. В., Щеголев А. В., Тихомирова О. В., Фадеев Б. П. Субарахноидальное кровоизлияние // Практическая нейрохирургия / Под редакцией Б. В. Гайдара. — СПб.:: Гиппократ, 2002. — С. 282—294. — 648 с. — 2000 экз. — ISBN 5-8232-0241-5 .
- ↑ Кравчук А. Д., Добровольский Г. Ф. Субарахноидальные кровоизлияния // Клиническое руководство по черепно-мозговой травме / Под редакцией А. Н. Коновалова , Л. Б. Лихтермана, А. А. Потапова. — М.:: ИД "ЭНЦИКЛОПЕДИЯ ИНТЕРНЕШНЛ", 2001. — Т. 2. — С. 369—375. — 676 с. — 1100 экз. — ISBN 5-900833-13-5 .
- Eisenberg HM, Gary HE Jr, Aldrich EF, Saydjari C, Turner B, Foulkes MA, Jane JA, Marmarou A, Marshall LF, Young HF. // J Neurosurg.. — 1990. — Т. 73 . — С. 688—698 . — .
- Hall JR. Impact of traumatic subarachnoid hemorrhage on outcome in nonpenetrating head injury. Part II: relationship to clinical course and outcome variables during acute hospitalization // J Trauma.. — 1997. — Т. 42 . — С. 1196—1197 . — .
- Fukuda T, Hasue M, Ito H. Does traumatic subarachnoid hemorrhage caused by diffuse brain injury cause delayed ischemic brain damage? Comparison with subarachnoid hemorrhage caused by ruptured intracranial aneurysms // Neurosurgery. — 1998. — Т. 43 . — С. 1040—1049 . — .
- Jeret JS, Mandell M, Anziska B, Lipitz M, Vilceus AP, Ware JA, Zesiewicz TA. Clinical predictors of abnormality disclosed by computed tomography after mild head trauma // Neurosurgery. — 1993. — Т. 32 . — С. 9—15 . — .
- Kakarieka A, Braakman R, Schakel EH. // Acta Neurochir (Wien). — 1994. — Т. 129 . — С. 1—5 . — .
- Kobayashi S, Nakazawa S, Yokota H, Isayama K, Yano M, Otsuka T. Traumatic subarachnoid hemorrhage in acute severe head injury // No To Shinkei. — 1988. — Т. 40 . — С. 1131—1135 . — .
- Levy ML, Rezai A, Masri LS, Litofsky SN, Giannotta SL, Apuzzo ML, Weiss MH. The significance of subarachnoid hemorrhage after penetrating craniocerebral injury: correlations with angiography and outcome in a civilian population // Neurosurgery. — 1993. — Т. 32 . — С. 532—540 . — .
- Freytag E. Autopsy findings in head injuries from blunt forces. Statistical evaluation of 1,367 cases // Arch Pathol. — 1963. — Т. 75 . — С. 402—413 . — .
- Jane J. A., Francel P. C. Age and outcome of head injury // Neurotrauma / Ed. Narayan R. K., Wilberger J. E., Povlishock J. T.. — 1996. — P. 793—804.
- ↑ Shigemori M, Tokutomi T, Hirohata M, Maruiwa H, Kaku N, Kuramoto S. Clinical significance of traumatic subarachnoid hemorrhage // Neurol Med Chir (Tokyo). — 1990. — Т. 30 . — С. 396—400 . — .
- Jurkovich GJ, Rivara FP, Gurney JG, Fligner C, Ries R, Mueller BA, Copass M. The effect of acute alcohol intoxication and chronic alcohol abuse on outcome from trauma (англ.) // JAMA . — 1993. — Vol. 270 . — P. 51—56 . — .
- Marek Z. Isolated subarachnoid hemorrhage as a medicolegal problem // Am J Forensic Med Pathol. — 1981. — Т. 2 . — С. 19—22 . — .
- ↑ Rinkel G.J., van Gijn J., Wijdicks E.F. (англ.) // : journal. — , 1993. — 9 January ( vol. 24 , no. 9 ). — P. 1403—1409 . — . 13 февраля 2010 года.
- ↑ Warrell, David A; Timothy M. Cox, et al . Oxford Textbook of Medicine, Fourth Edition, Volume 3 (англ.) . — Oxford, 2003. — P. 1032—1034. — ISBN 0-19-857013-9 .
- ↑ Armin S.S., Colohan A.R., Zhang J.H. Traumatic subarachnoid hemorrhage: Our current understanding and its evolution over the past half century (англ.) // Neurological Research : journal. — 2006. — June ( vol. 28 , no. 4 ). — P. 445—452 . — doi : . — .
- ↑ Longmore, Murray; Ian Wilkinson, Tom Turmezei, Chee Kay Cheung. (англ.) . — Oxford University Press , 2007. — P. 841. — ISBN 0-19-856837-1 .
- ↑ Ramrakha, Punit; Kevin Moore. Oxford Handbook of Acute Medicine, 2nd edition (англ.) . — Oxford University Press , 2007. — P. 466—470. — ISBN 0-19-852072-6 .
- McCarron M.O., Alberts M.J., McCarron P. (англ.) // : journal. — 2004. — Vol. 75 , no. 3 . — P. 491—493 . — doi : . — . — PMC . 30 января 2008 года.
- Allman, Keith G.; Iain H. Wilson. Oxford Handbook of Anaesthesia, 2nd edition (англ.) . — Oxford University Press , 2006. — P. 408—409. — ISBN 0198566090 .
- Banki N.M., Kopelnik A., Dae M.W., et al . (англ.) // : journal. — , 2005. — Vol. 112 , no. 21 . — P. 3314—3319 . — doi : . — . 8 июня 2011 года.
- Servadei F., Murray G.D., Teasdale G.M., et al . Traumatic subarachnoid hemorrhage: demographic and clinical study of 750 patients from the European brain injury consortium survey of head injuries (англ.) // Neurosurgery : journal. — 2002. — February ( vol. 50 , no. 2 ). — P. 261—267 . — doi : . — .
- ↑ Suarez J.I., Tarr R.W., Selman W.R. Aneurysmal subarachnoid hemorrhage (англ.) // The New England Journal of Medicine . — 2006. — January ( vol. 354 , no. 4 ). — P. 387—396 . — doi : . — .
- ↑ Cruickshank A., Auld P., Beetham R., et al . (англ.) // : journal. — 2008. — May ( vol. 45 , no. Pt 3 ). — P. 238—244 . — doi : . — . 30 мая 2008 года.
- ↑ Teunissen L.L., Rinkel G.J., Algra A., van Gijn J. (англ.) // : journal. — , 1996. — 1 March ( vol. 27 , no. 3 ). — P. 544—549 . — . 16 января 2010 года.
- ↑ Kowalski R.G., Claassen J., Kreiter K.T., et al . (англ.) // JAMA : journal. — 2004. — February ( vol. 291 , no. 7 ). — P. 866—869 . — doi : . — . 16 января 2010 года.
- Rosen D., Macdonald R. Subarachnoid hemorrhage grading scales: A systematic review (англ.) // Neurocritical Care : journal. — 2005. — Vol. 2 , no. 2 . — P. 110—118 . — doi : . — .
- Hunt W., Hess R. Surgical risk as related to time of intervention in the repair of intracranial aneurysms (англ.) // : journal. — 1968. — Vol. 28 , no. 1 . — P. 14—20 . — .
- Fisher C., Kistler J., Davis J. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning (англ.) // Neurosurgery : journal. — 1980. — Vol. 6 , no. 1 . — P. 1—9 . — doi : . — .
- Claassen J., Bernardini G.L., Kreiter K., et al . (англ.) // : journal. — , 2001. — September ( vol. 32 , no. 9 ). — P. 2012—2020 . — doi : . — . 6 июня 2011 года.
- Teasdale G., Drake C., Hunt W., Kassell N., Sano K., Pertuiset B., De Villiers J. A universal subarachnoid hemorrhage scale: Report of a committee of the World Federation of Neurosurgical Societies (англ.) // : journal. — 1988. — Vol. 51 , no. 11 . — P. 1457 . — . — PMC .
- ↑ Ogilvy C.S., Carter B.S. A proposed comprehensive grading system to predict outcome for surgical management of intracranial aneurysms (англ.) // Neurosurgery : journal. — 1998. — May ( vol. 42 , no. 5 ). — P. 959—968 . — doi : . — .
- Dandy W.E. Intracranial aneurysm of the internal carotid artery: Cured by operation (англ.) // : journal. — 1938. — Vol. 107 , no. 5 . — P. 654—659 . — doi : . — . — PMC .
- Guglielmi G., Viñuela F., Dion J., Duckwiler G. Electrothrombosis of saccular aneurysms via endovascular approach. Part 2: Preliminary clinical experience (англ.) // : journal. — 1991. — Vol. 75 , no. 1 . — P. 8—14 . — .
- ↑ Molyneux A.J., Kerr R.S., Yu L.M., et al . International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: A randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion (англ.) // The Lancet : journal. — Elsevier , 2005. — Vol. 366 , no. 9488 . — P. 809—817 . — doi : . — .
- van der Schaaf I., Algra A., Wermer M., et al . (англ.) // Cochrane Database of Systematic Reviews : journal. — 2005. — No. 4 . — P. CD003085 . — doi : . — . 28 марта 2020 года.
- Campi A., Ramzi N., Molyneux A.J., et al . (англ.) // : journal. — , 2007. — Vol. 38 , no. 5 . — P. 1538—1544 . — doi : . — . 7 января 2010 года.
- Piotin M., Spelle L., Mounayer C., et al . (англ.) // Radiology : journal. — 2007. — Vol. 243 , no. 2 . — P. 500—508 . — doi : . — . 7 октября 2008 года.
- Raymond J., Guilbert F., Weill A., et al . (англ.) // : journal. — , 2003. — Vol. 34 , no. 6 . — P. 1398—1403 . — doi : . — . 9 июня 2010 года.
- ↑ Dorhout Mees S., Rinkel G., Feigin V., et al . Calcium antagonists for aneurysmal subarachnoid haemorrhage (англ.) // Cochrane Database of Systematic Reviews : journal. — 2007. — No. 3 . — P. CD000277 . — doi : . — .
- КМН — Клиника малоинвазивной нейрохирургии. . www.minclinic.ru. Дата обращения: 6 октября 2016. 9 октября 2016 года.
- Allen G.S., Ahn H.S., Preziosi T.J., et al . Cerebral arterial spasm: A controlled trial of nimodipine in patients with subarachnoid hemorrhage (англ.) // The New England Journal of Medicine : journal. — 1983. — Vol. 308 , no. 11 . — P. 619—624 . — .
- Vergouwen M.D., Vermeulen M., Roos Y.B. Effect of nimodipine on outcome in patients with traumatic subarachnoid haemorrhage: A systematic review (англ.) // The Lancet : journal. — Elsevier , 2006. — December ( vol. 5 , no. 12 ). — P. 1029—1032 . — doi : . — .
- Rosengart A.J., Huo J.D., Tolentino J., et al . Outcome in patients with subarachnoid hemorrhage treated with antiepileptic drugs (англ.) // : journal. — 2007. — August ( vol. 107 , no. 2 ). — P. 253—260 . — doi : . — .
- Naval N.S., Stevens R.D., Mirski M.A., Bhardwaj A. Controversies in the management of aneurysmal subarachnoid hemorrhage (англ.) // : journal. — 2006. — February ( vol. 34 , no. 2 ). — P. 511—524 . — doi : . — .
- Liu K.C., Bhardwaj A. Use of prophylactic anticonvulsants in neurologic critical care: a critical appraisal (неопр.) // Neurocritical Care. — 2007. — Т. 7 , № 2 . — С. 175—184 . — doi : . — .
- ↑ Rosengart A.J., Schultheiss K.E., Tolentino J., Macdonald R.L. (англ.) // : journal. — , 2007. — August ( vol. 38 , no. 8 ). — P. 2315—2321 . — doi : . — . 24 июля 2008 года.
- Naidech A.M., Kreiter K.T., Janjua N., et al . (англ.) // : journal. — , 2005. — March ( vol. 36 , no. 3 ). — P. 583—587 . — doi : . — . 6 июня 2011 года.
- Lindsay, Kenneth W; Ian Bone, Robin Callander. Neurology and Neurosurgery Illustrated (неопр.) . — United States: , 1993. — ISBN 0-443-04345-0 .
- Feigin V.L., Rinkel G.J., Lawes C.M., et al . (англ.) // : journal. — , 2005. — Vol. 36 , no. 12 . — P. 2773—2780 . — doi : . — . 6 июня 2011 года.
- Greebe P., Rinkel G.J. (англ.) // : journal. — , 2007. — April ( vol. 38 , no. 4 ). — P. 1222—1224 . — doi : . — . 26 ноября 2010 года.
- Lanterna L.A., Ruigrok Y., Alexander S., et al . Meta-analysis of APOE genotype and subarachnoid hemorrhage: clinical outcome and delayed ischemia (англ.) // : journal. — , 2007. — August ( vol. 69 , no. 8 ). — P. 766—775 . — doi : . — .
- Powell J., Kitchen N., Heslin J., Greenwood R. (англ.) // : journal. — 2002. — June ( vol. 72 , no. 6 ). — P. 772—781 . — doi : . — . — PMC . 14 июля 2007 года.
- Schneider H.J., Kreitschmann-Andermahr I., Ghigo E., Stalla G.K., Agha A. (англ.) // JAMA : journal. — 2007. — September ( vol. 298 , no. 12 ). — P. 1429—1438 . — doi : . — . 25 января 2010 года.
См. также
- 2020-12-31
- 1