Interested Article - Оксид хрома(II)

- 2021-11-13
- 1
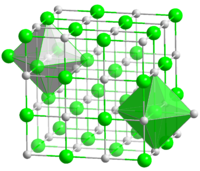
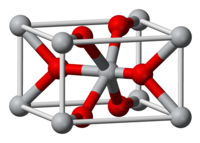
Оксид хрома(II) (закись хрома) — это черные или красные кристаллы. Основный оксид хрома . Неорганическое соединение.
Получение
Получают окислением амальгамы хрома CrHg 3 или CrHg азотной кислотой или кислородом :
Или восстановлением оксида хрома(III) :
Также можно получить термическим разложением карбонила С
Химические свойства
При 697°С разлагается на металлический хром и оксид хрома(III) :
Восстанавливается водородом до металлического хрома при 1000°С:
Также можно восстановить коксом:
Проявляет основные свойства, к примеру, растворяется в соляной кислоте с выделением воды и хлорида хрома(II):
Не растворим в разбавленных серной и азотной кислотах.
При нагревании на воздухе быстро окисляется до оксида хрома(III) , проявляя свои сильные восстановительные свойства. При температуре белого каления восстановительные свойства усиливаются настолько, что оксид хрома(II) начинает отнимать кислород у углекислого газа :
Физические свойства
Существует в двух полиморфных формах. Может быть красным (не пирофорен ) и чёрным пирофорным порошком (самовоспламеняется на воздухе), поэтому чёрную модификацию сохраняют под слоем воды (с водой не взаимодействует). Образует гексагональные пластинчатые кристаллы. Как и все оксиды хрома, тугоплавок, температура плавления 1550°С. Не растворим в воде.
Токсичность
Соединения хрома с валентностью менее 6 малотоксичны. Опасными ядами и канцерогенами признаны соединения хрома с валентностью 6+, такие как Оксид хрома (VI) .
Литература
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 380
- Неорганические соединения хрома: Справочник. - Л.: Химия, 1981. - С. 9
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М. : Академия, 2007. — Т. 3. — 352 с.
Источники
- www.xumuk.ru/encyklopedia/2/5083.html
Примечания
|
|
Это
заготовка статьи
по
химии
. Помогите Википедии, дополнив её.
|
- 2021-11-13
- 1