Interested Article - Оксид таллия(III)

- 2020-05-09
- 1
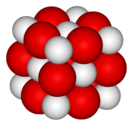
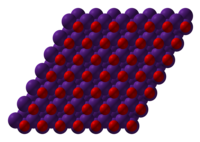
Оксид таллия(III) — бинарное неорганическое соединение металла таллия и кислорода с формулой Tl 2 O 3 , тёмно-коричневые кристаллы. Основный оксид.
Получение
- При нагревании таллий горит на воздухе:
- Окисление таллия концентрированной перекисью водорода :
- Термическое разложение свежеосаждённой гидроокиси таллия :
-
- осадок состоит из полигидрата оксида таллия Tl 2 O 3 • n H 2 O.
- Разложение кристаллогидрата нитрата таллия :
- В природе встречается минерал авиценнит , состоящий из оксида таллия.
- Окисление гидроксида таллия(1):
- Взаимодействие солей таллия с водой:
Физические свойства
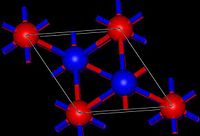
Оксид таллия — тёмно-коричневые кристаллы кубической сингонии , пространственная группа I a3 , параметры ячейки a = 1,059 нм, Z = 16.
Химические свойства
- При нагревании разлагается:
- Реагирует с концентрированными кислотами:
- с двухосновными концентрированными кислотами образуются кислые соли:
- и щелочами при сплавлении образует :
- Восстанавливается водородом до закиси:
- с концентрированной соляной кислотой проявляются окислительные свойства оксида таллия:
- Окислительные свойства оксида таллия проявляются и в других реакциях:
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М. : Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4 .
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М. — Л. : Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0 .
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М. : Мир, 1971. — Т. 1. — 561 с.
- 2020-05-09
- 1




![{\displaystyle {\ce {2TlOH + O2 ->[400 C^0] Tl2O3 + H2O}}}](/images/008/602/8602473/8.jpg?rand=577502)
![{\displaystyle {\ce {2TlCl3 + 3H2O ->[100C^0] 6HCl + Tl2O3}}}](/images/008/602/8602473/9.jpg?rand=787984)


![{\displaystyle {\ce {Tl2O3 + 4H2SO4 -> 2H[Tl(SO4)2] + 3H2O}}}](/images/008/602/8602473/12.jpg?rand=241111)


![{\displaystyle {\mathsf {Tl_{2}O_{3}+8HCl\ {\xrightarrow {}}\ 2H[TlCl_{2}]+2Cl_{2}\uparrow +3H_{2}O}}}](/images/008/602/8602473/15.jpg?rand=443413)