Interested Article - Сукцинатдегидрогеназа

- 2021-06-15
- 1
Сукцинатдегидрогеназа или сукцинат-убихинон-оксидорекдуктаза , также известная как комплекс II — белковый комплекс, расположенный во внутренней мембране митохондрий и мембранах многих прокариотических организмов. Одновременно участвует в цикле трикарбоновых кислот и дыхательной цепи переноса электронов .
На шестой стадии цикла трикарбоновых кислот сукцинатдегидрогеназа катализирует окисление сукцината до фумарата , восстанавливая убихинон до убихинола .
История
В 1910 году учёный Танберг обнаружил, что изолированная мышечная ткань животных способна окислять сукцинат ( янтарную кислоту ) , из чего был сделан вывод, что для осуществления этой реакции есть некий фермент. Неизвестный фермент, позже идентифицированный как сукцинатдегидрогеназа, стал предметом активных исследований начиная с 1950-х годов, когда на гребне активно развивавшейся биохимии и исследований клеточного дыхания зарождалась биоэнергетика . В 1954 году американскому учёному впервые удалось выделить очищенную сукцинатдегидрогеназу в виде раствора . Доступность растворимой формы фермента ознаменовала прорыв в исследованиях, и за последующие пятнадцать лет были идентифицированы все основные компоненты сукцинатдегидрогеназного комплекса. Из ранних исследований растворимой формы стало понятно, что этот белок содержит железо и флавин . Сукцинатдегидрогениаза оказалась первым исследованным белком, у которого был обнаружен ковалентно присоединённый флавинадениндинуклеотид . Кроме того, фермент содержал лабильные атомы серы .
В 1959 году, сразу же после открытия кофермента Q , Циглер и Доик выделили сукцинатдегидрогеназу, которая была растворена в холевой кислоте , содержала флавин, железо и гем и могла восстанавливать коэнзим Q. Эти результаты кардинально отличались от тех, которые были получены при исследовании водорастворимой сукцинатдегидрогеназы, которая не содержала гема и не могла восстанавливать коэнзим Q. Возникшее противоречие дало начало ожесточённым спорам о правильности и качестве процедур выделения и возможном загрязнении, которые продолжались вплоть до начала 1970-х годов. В начале 60-х годов сформировалось представление о дыхательной цепи переноса электронов , а в результате проводившихся экспериментов, в 1962 году удалось выделить три первых дыхательных комплекса. Выделенный из митохондрий комплекс с сукцинатдегидрогеназной активностью получил название дыхательный комплекс II и несколько позже был отождествлён с водорастворимой сукцинатдегидрогеназой. Следует отметить, что убедительно показать наличие в сукцинатдегидрогеназе железосерных кластеров и определить их строение удалось только 30 лет спустя после её выделение. Этого удалось добиться с появлением новых методик ЭПР , которые были испробованы на этом ферменте .
Структурная организация комплекса II

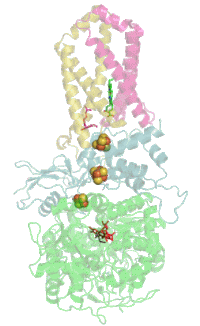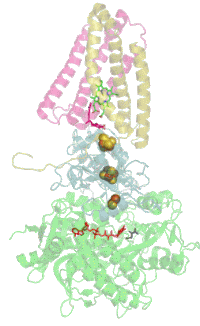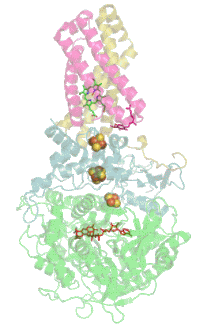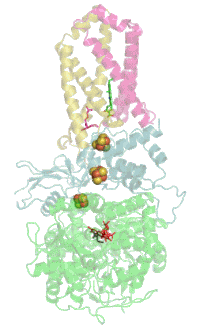
Мономер комплекса II в митохондриях млекопитающих , простейших , грибов и многих бактерий состоит из четырёх субъединиц , кодируемых ядерным геномом: двух гидрофильных и двух гидрофобных . Молекулярная масса полного мономера по разным данным составляет от ~125 кДа до ~140 кДа . Две гидрофильные субъединицы обращены в матрикс. Субъединица А представляет собой флавопротеин , а субъединица B несёт железосерный белок. На субъединице A расположен ковалентно связанный ФАД , и сайт связывания сукцината , а на B находятся три железосерных кластера: [2Fe-2S], [4Fe-4S] и [3Fe-4S]. У человека субъединица А представлена двумя изоформами (субъединицы типа I и II), эти изоформы также обнаружены у Ascaris suum и Caenorhabditis elegans . Гидрофобные субъединицы C и D — трансмембранные белки. Вместе они образуют цитохром b 560 , в шести трансмембранных α-спиралях которого расположен гем b и сайт связывания убихинона . Две молекулы , один кардиолипин и один , которые заполняют гидрофобное пространство между субъединицами C и D ниже гема b .
Комплекс II не взаимодействует с другими комплексами дыхательной цепи электронов и не входит в состав супрамолекулярных комплексов — респирасом . Тем не менее на культурах тканей человека и крыс, а также на тканях полученных от цельных организмов, было показано, что комплекс II может образовывать каталитически активную высокомолекулярную форму из множества комплексов с молекулярным весом от 500 до 1000 кДа в интактных тканях и от 400 до 670 кДа в культурах клеток .
Значительно меньше известно о комплексе II у растений , он и по сей день остаётся одним из самых неизученных комплексов растительных митохондрий. Последние эксперименты по его выделению из арабидопсиса и исследование его методом показали, что у растений он, по-видимому, состоит из восьми субъединиц, четыре из которых идентичны субъединицам обычным комплекса II, а четыре специфичных для растений и не обнаруживаются в митохондриях других эукариот. Аналогичные результаты были получены и для картофеля .
Таблица субъединиц
| No. | Субъединица | Белок человека | Молекулярная масса | Семейство белков Pfam |
|---|---|---|---|---|
| 1 | SdhA | 72 кДа | Pfam , Pfam | |
| 2 | SdhB | 30 кДа | Pfam , Pfam | |
| 3 | SdhC | CDHB_HUMAN | 18 кДа | Pfam |
| 4 | SdhD | 15 кДа | Pfam |
Сайт связывания убихинона
Сайт связывания убихинона расположен в углублении, образованном субъединицами B, C и D. Здесь убихинон стабилизируется боковыми группами гистидина -207 субъединицы B, серином -27 и аргинином -31 субъединицы C и тирозином -83 субъединицы D. Хиноновое кольцо окружено изолейцином -28 субъединицы C и пролином -160 субъединицы B. Эти аминокислотные остатки вместе с изолейцином -209, триптофаном -163 и триптофаном -164 субъединицы B, и серином-27 субъединицы C, образуют гидрофобное окружение в кармане для связывания хинона .
Сайт связывания сукцината
На субъединице A расположен сайт связывания и окисления сукцината. тирозина-254, гистидина-354 и аргинина-399 этой субъединицы стабилизируют молекулу сукцината в то время как ФАД окисляется и передаёт электроны на первый железосерный кластер , [2Fe-2S] .
Редокс-центры
Сайт связывания сукцината и сайт связывания убихинона соединены цепочкой из редокс-центров, состоящей из ФАД и трёх железосерных кластеров. Эта цепочка простирается на 40 Å через всё тело фермента. Приблизительная дистанция между кофакторами не превышает физиологический предел для переноса электронов в 14 Å .
Механизм реакции
Комплекс II окисляет сукцинат до фумарата и восстанавливает убихинон :
- Сукцинат + Q → Фумарат + QH 2
Электроны от сукцината сначала переносятся на ФАД, а затем через кластеры Fe-S на Q. Электронный транспорт в комплексе не сопровождается генерацией протонного градиента . Образовавшиеся при окислении сукцината 2H + остаются на той же стороне мембраны, то есть в матриксе , и затем снова поглощаются при восстановлении хинона. Таким образом комплекс II не вносит вклада в создание протонного градиента на мембране и работает только как переносчик электронов от сукцината к убихинону .


Окисление сукцината
О точном механизме окисления сукцината известно довольно мало. Рентгеноструктурный анализ выявил, что ФАД , глутамат -255, аргинин -286, и гистидин -242 субъединицы A могут быть кандидатами для осуществления реакции депротонирования. Существует два возможных механизма этой реакции элиминирования (отщепления): E2 и E1cb. В случая E2 — это согласованный механизм. Основные остатки или кофактор депротонируют альфа углерод, а ФАД принимает гидрид -анион от бета углерода, окисляя сукцинат до фумарата — см. рис. 1. В случае механизма E1cb, прежде чем ФАД присоединит гидрид-анион, образуется енольная форма сукцината, как это показано на рис. 2. Что бы определить какой механизм имеет место на самом деле, требуется провести дополнительные исследования сукцинатдегидрогеназы.
После завершения реакции фумарат , который слабо связан с активным центром фермента, легко диссоциирует. Существуют данные из которых следует, что цитозольный субстратсвязывающий домен сукцинатдегидрогеназы претерпевает конформационные изменения: после ухода продукта фермент находится в открытом виде, а связав новый субстрат, переходит в закрытое состояние, плотно смыкаясь вокруг него .
Перенос электронов


В результате окисления сукцината его электроны переносятся на ФАД , а затем передаются по цепи из железосерных кластеров от кластера [Fe-S] к [3Fe-4S]. Там эти электроны переносятся на ожидающую в сайте связывания молекулу убихинона .
Восстановление убихинона
В активном сайте убихинон стабилизирован за счёт водородных связей между его карбонильным атомом кислорода в первом положении и тирозином -83 субъединицы D. Переход электронов на железосерный кластер [3Fe-4S] заставляет убихинон перейти в другое положение. В результате образуется вторая водородная связь между карбонильной группой убихинона в четвёртом положении и серином-27 субъединицы C. После того как в процессе восстановления убихинон принимает первый электрон, он превращается в активный радикал семихинон , который после связывания второго электрона от кластера [3Fe-4S] полностью восстанавливается до убихинола . Полный механизм восстановления убихинона изображён на рисунке 3 .
Гем b
Хотя точная функция гема сукцинатдегидрогеназы всё ещё не известна, некоторые исследователи утверждают, что первый электрон , поступающий к убихинону через [3Fe-4S], может быстро перемещаться вперёд-назад между гемом и связанным убихиноном. Таким образом гем играет роль стока электронов, предотвращая их взаимодействие с молекулярным кислородом, которое привело бы к образованию активных форм кислорода .
Также есть предположение, что для того, чтобы не давать электрону напрямую попадать с кластера [3Fe-4S] на гем, действует специальный воротный механизм. Вероятный кандидат на роль ворот — гистидин -207 субъединицы B, который расположен прямо между железосерным кластером и гемом, неподалёку от связанного убихинона; вероятно, он может управлять потоком электронов между этими редокс-центрами .
Ингибиторы
Существует два класса ингибиторов комплекса II: одни блокируют карман для связывания сукцината, а другие — карман для связывания убихинола . К ингибиторам, имитирующем убихинол, относятся карбоксин и теноилтрифторацетон . К ингибиторам-аналогам сукцината принадлежит синтетическое соединение малонат а также компоненты цикла Кребса , малат и оксалоацетат . Интересно, что оксалоацетат является одним из самых сильных ингибиторов комплекса II. По какой причине обычный метаболит цикла трикарбоновых кислот ингибирует комплекс II остаётся не ясным, хотя предполагают, что таким образом он может выполнять защитную роль, сводя к минимуму обратный транспорт электронов в комплексе I , в результате которого происходит образование супероксида .
Ингибиторы, имитирующие убихинол, использовались как фунгициды в сельском хозяйстве начиная с 1960-х годов. Например, карбоксин в основном использовался для заболеваний вызванных базидиомицетами , такими как стеблевы ржавчины и заболевания вызванные . В последнее время им на смену пришли другие соединения с более широким спектром подавляемых патогенов. К таким соединениям относятся боскалид , пентиопирад и флуопирам . Некоторые сельскохозяйственно значимые грибы не восприимчивы к действию этого нового поколения ингибиторов .
Роль в заболеваниях
Фундаментальная роль сукцинатдегидрогеназы в цепи переноса электронов митохондрий делает её жизненно важной для большинства многоклеточных организмов , делеция генов этого фермента из генома летальна, что было показано на ранних эмбрионах мышей.
- Мутации субъединицы A могут приводить к синдрому Лея , митохондриальной энцефалопатии и оптической нейропатии .
- Мутации субъединицы B могут приводить к образованию опухолей из хромаффинных клеток , вызывая наследственную параганглиому и феозромацитому . Такие опухоли как правило оказываются злокачественными . Также эти мутации могут приводить к снижению продолжительности жизни и увеличению продукции супероксида .
- Мутации субъединицы C могут приводить к снижению продолжительности жизни, увеличению продукции супероксида , наследственной параганглиоме и феохромацитоме . Такие опухоли как правило оказываются доброкачественными . Мутации этого типа встречаются довольно редко.
- Мутации субъединицы D могут приводить к наследственную параганглиоме и феохромацитоме . Опухоли доброкачественные и обычно располагаются на голове и шее. Эти мутации также могут приводить к снижению продолжительности жизни, увеличению продукции супероксида .
Сукцинатдегидрогеназа млекопитающих участвует не только в образовании энергии в митохондриях, но также играет роль в чувствительности клетки к кислороду и подавлении опухолей; сейчас эти свойства являются объектом пристального изучения .
См. также
- Окислительное фосфорилирование
- НАДН-дегидрогеназный комплекс
- Цитохром- bc 1 -комплекс
- Цитохромоксидаза
- Фумаратредуктаза
- Флавопротеины
Примечания
- ↑ , с. 239.
- T. Thunberg, Skand. Arch. Physiol. , 24 (1910) 23; 41 (1920)1
- Singer, T. P., Kearney, E. B. and Kenney, W. C. / ed. A. Meister. — New York, USA.: John Wiley & Sons , Inc., 1973. — Vol. 37. — (Advances in Enzymology - and Related Areas of Molecular Biology). — ISBN 9780470122822 . 30 мая 2016 года.
- ↑ / edited by Russ Hille, Susan Miller, Bruce Palfey. — 1 edition. — Berlin: Walter de Gruyter & Co, 30 Jun. 2013. — Vol. 2. — P. 141-143. — 436 p. — ISBN 978-3110298284 . 1 июня 2016 года.
- ↑ Kovářová, N., Mráček, T., Nůsková, H., Holzerová, E., Vrbacký, M., Pecina, P., Hejzlarová, K., Kľučková, K., Rohlena, J., Neuzil, J., Houštěk, J. High Molecular Weight Forms of Mammalian Respiratory Chain Complex II (англ.) // PLoS ONE : journal. — 2013. — August ( vol. 8 , no. 8 ). — P. e71869 . — doi : .
- Tomitsuka E., Hirawake H., Goto Y., Taiwaki M., Harada S., Kita K. Direct evidence for two distinct forms of the flavoprotein subunit of human mitochondrial complex II (succinate-ubiquinone reductase) (англ.) // J. Biochem : journal. — 2003. — Vol. 134 , no. 2 . — P. 191—195 . — doi : . — .
- ↑ Yankovskaya V., Horsefield R., Törnroth S., etal. Architecture of succinate dehydrogenase and reactive oxygen species generation (англ.) // Science : journal. — 2003. — January ( vol. 299 , no. 5607 ). — P. 700—704 . — doi : . — .
- A. Harvey Millar, Holger Eubel, Lothar Jansch, Volker Kruft, Joshua L. Heazlewood, Hans-Peter Braun. (англ.) // Plant Mol Biol : journal. — 2004. — September ( vol. 56 , no. 1 ). — P. 77—90 . — .
- Sun F., Huo X., Zhai Y., Wang A., Xu J., Su D., etal. (англ.) // Cell : journal. — Cell Press , 2005. — Vol. 121 , no. 7 . — P. 1043—1057 . — doi : . — .
- Horsefield R., Yankovskaya V., Sexton G., etal. Structural and computational analysis of the quinone-binding site of complex II (succinate-ubiquinone oxidoreductase): a mechanism of electron transfer and proton conduction during ubiquinone reduction (англ.) // J. Biol. Chem. : journal. — 2006. — March ( vol. 281 , no. 11 ). — P. 7309—7316 . — doi : . — .
- Kenney W.C. The reaction of N-ethylmaleimide at the active site of succinate dehydrogenase (англ.) // J. Biol. Chem. : journal. — 1975. — April ( vol. 250 , no. 8 ). — P. 3089—3094 . — .
- , с. 331-333.
- , с. 240.
- T.M. Iverson. Catalytic mechanisms of complex II enzymes: A structural perspective (англ.) // : journal. — 2013. — May ( vol. 1827 , no. 5 ). — P. 648—657 . — doi : .
- ↑ Tran Q.M., Rothery R.A., Maklashina E., Cecchini G., Weiner J.H. The quinone binding site in Escherichia coli succinate dehydrogenase is required for electron transfer to the heme b (англ.) // J. Biol. Chem. : journal. — 2006. — October ( vol. 281 , no. 43 ). — P. 32310—32317 . — doi : . — .
- Muller F.L., Liu Y., Abdul-Ghani M.A., etal. High rates of superoxide production in skeletal-muscle mitochondria respiring on both complex I- and complex II-linked substrates (англ.) // : journal. — 2008. — January ( vol. 409 , no. 2 ). — P. 491—499 . — doi : . — .
- Avenot H. F., Michailides T. J.,. Progress in understanding molecular mechanisms and evolution of resistance to succinate dehydrogenase inhibiting (SDHI) fungicides in phytopathogenic fungi (англ.) // Crop Protection : journal. — 2010. — Vol. 29 , no. 7 . — P. 643 . — doi : .
- Dubos T., Pasquali M., Pogoda F., Casanova A. L., Hoffmann L., Beyer M.,. Differences between the succinate dehydrogenase sequences of isopyrazam sensitive Zymoseptoria tritici and insensitive Fusarium graminearum strains (англ.) // Pesticide Biochemistry and Physiology : journal. — 2013. — Vol. 105 . — P. 28 . — doi : .
- Bardella Chiara , Pollard Patrick J. , Tomlinson Ian. // Biochimica et Biophysica Acta (BBA) - Bioenergetics. — 2011. — Ноябрь ( т. 1807 , № 11 ). — С. 1432—1443 . — ISSN . — doi : .
- Yang Ming , Pollard Patrick J. // Cancer Cell. — 2013. — Июнь ( т. 23 , № 6 ). — С. 709—711 . — ISSN . — doi : .
Литература
- Физиология растений / Под ред. И. П. Ермакова. — М. : Академия, 2005. — 634 с.
- Дэвид Л. Нельсон, Майкл М. Кокс. Основы биохимии Ленинджера. Биоэнергетика и метаболизм. = Leninger Principles of Biochemistry. — Бином. Лаборатория знаний, 2012. — Т. 2. — 692 с. — (Лучший зарубежный учебник). — ISBN 978-5-94774-365-4 .
- 2021-06-15
- 1