Interested Article - Тонкослойная хроматография

- 2021-11-13
- 1

Тонкослойная хроматография — хроматографический метод, в котором в качестве неподвижной фазы используется тонкий слой адсорбента . Метод основан на том, что разделяемые вещества по-разному распределяются между сорбирующим слоем и протекающим через него элюентом , вследствие чего расстояние, на которое эти вещества смещаются по слою за одно и то же время, различается.
Тонкослойная хроматография даёт большие возможности для качественного анализа и разделения веществ, поскольку и сорбент , и элюент могут варьироваться в широких пределах. Пластинки с различными сорбентами выпускаются промышленно, что делает возможным быстрое и рутинное использование метода. Разновидностью тонкослойной хроматографии является более надёжная и воспроизводимая высокопроизводительная тонкослойная хроматография , для которой используются специальные пластины и сложное оборудование.
Тонкослойная хроматография была открыта в 1889 году, получила существенное развитие в середине XX века и до настоящего времени широко используется в фундаментальной и прикладной науке, а также фармацевтической, медицинской и пищевой сферах.
История
Предпосылкой к созданию метода стало использование бумажной хроматографии Кристианом Фридрихом Шёнбейном в 1861 году . Этот метод получил развитие в работах Гоппельсредера, ученика Шёнбейна, в 80-х годах XIX века . Методика в то время носила название капиллярного анализа. Работа фактически была забыта, а в 1944 году хроматография на целлюлозе была переоткрыта Консденом и др. Впервые метод тонкослойной хроматографии почти в том виде, в котором он известен сейчас, был применён голландским биологом Мартином Бейеринком в 1889 году. Изучая диффузию серной и соляной кислот в желатине , Бейеринк обнаружил, что соляная кислота перемещалась быстрее, чем серная. В своих экспериментах он детектировал зону соляной кислоты, добавляя на слой раствор хлорида серебра , а зону серной кислоты — раствор хлорида бария . В 1898 году Вийсмен применил подобный метод для определения ферментов в диастазе солода и впервые употребил флуоресцентную детекцию; чувствительность метода на то время позволила определить присутствие вещества в количестве 40 пг . Несмотря на это, и , разработанная М. С. Цветом в начале XX века, и тонкослойная хроматография фактически не использовались до 30-х годов .
В 1938 году Измайлов и Шрайбер сообщили о проведении круговой хроматографии на слое оксида алюминия , нанесённом на стеклянную пластинку. При этом слои разделяемых веществ приобретали вид концентрических кругов. Исследователи продемонстрировали, что метод можно применять для испытания сорбентов и элюентов для колоночной хроматографии .
Существенные успехи в разработке метода ТСХ были достигнуты Ю. Кирхнером и сотрудниками, которые в 1945—1954 годах работали над выделением пахучих веществ из цитрусовых хроматографическими методами. Убедившись в неприменимости бумажной хроматографии для их целей, они разработали метод, сочетающий преимущества бумажной и колоночной хроматографии, однако он не привлекал особого внимания до тех пор, пока не был разрекламирован фирмами и Merck .
До середины 50-х годов XX века для описания метода использовали термины «хроматография на полосках», «хроматография на пластинках», «хроматография в тонких плёнках», «хроматография в открытой колонке», однако термин «тонкослойная хроматография», который был предложен Э. Шталем в 1956 году оказался настолько удачным, что вытеснил все остальные. Примерно в это же время авторитетный журнал Chemical Abstracts выделил публикации по этой теме отдельным индексом, признав его самостоятельным методом аналитической химии .
Неподвижная фаза
Пластинки с нанесённым адсорбционным слоем появились в продаже в 1961 году и сейчас практически вытеснили из употребления самодельные. На подложку, обычно изготовленную из стекла , пластика или алюминия , наносят сорбенты с размером частиц 10—20 мкм. Толщина слоя составляет от 100—250 мкм (для аналитических пластинок) до 2 мм (для препаративных пластинок). Стандартный формат пластинок — 20×20 см, но существуют также форматы 10×20, 5×20 и 2,5×5 см. Пластинку необходимого размера можно вырезать самостоятельно. Выпускаются также пластинки с каналами, облегчающими нанесение образцов и препятствующие их смешиванию. Пластинки с преадсорбционным слоем производят из материала с более низкой адсорбирующей способностью ( целлюлоза , кизельгур ). Такие слои служат для очистки образца, а также для формирования узкой полосы перед достижением образцом разделяющего слоя .
Пластинки для высокопроизводительной ТСХ были предложены в 1975 году и также имеют размеры 10×20 и 10×10 см при толщине адсорбционного слоя в 200 мкм. Такие пластинки обладают повышенной разрешающей способностью, более низким пределом обнаружения , требуют меньше растворителя для элюирования. В 1995 году появились улучшенные высокопроизводительные пластинки со сферическими частицами. В 2001 году на рынке были предложены пластинки с монолитным слоем, которые нашли применение лишь в научных исследованиях .
В качестве адсорбентов исторически применялись несколько материалов: оксид алюминия (кислый, нейтральный и основный), кизельгур (очищенная диатомитовая земля), полиамиды , катионообменные смолы . Эти материалы и сегодня упоминаются в учебниках и научных статьях, однако они утратили своё значение, и их производство, в основном, остановлено .
Для упрочнения пластин может использоваться связывающее вещество. Ранее для этих целей, например, в пластинках с силикагелем G, широко использовался гипс в количестве 13 массовых процентов. В современных имеющихся в продаже пластинках используются органические связывающие вещества (например, метакрилаты ). В литературе описано также применение крахмала и карбоксиметилцеллюлозы . Фактически, связывающее вещество является компонентом неподвижной фазы, поэтому использование различных связывающих веществ может привести к различным результатам хроматографии .
Чтобы сделать определение положений зон веществ более удобным, в адсорбционный слой могут вводить флуоресцентный индикатор. При облучении такого слоя ультрафиолетовым излучением с длиной волны 254 нм он даёт зелёное (F 254 ) или бледно-голубое (F 254 s ) свечение. При этом зона вещества, поглощающего ультрафиолет, выглядит на фоне флуоресцирующего слоя тёмной .
Силикагель
Одним из самых важных материалов для неподвижных фаз является силикагель, он используется в более чем 90 % пластин для тонкослойной хроматографии. Силикагель получают путём осаждения кислотой из растворов силикатов или гидролизом производных кремния . Диаметр получаемых частиц зависит от условий, например, изменение pH позволяет получать силикагель с площадью поверхности от 200 до 800 м²/г. С химической точки зрения, поверхность силикагеля содержит (Si–O–Si) и группы (Si–O–H). Силанольные группы могут быть свободными, вицинальными или геминальными. Они также могут взаимодействовать друг с другом за счёт образования водородных связей .
Таким образом, силикагель характеризуется множеством варьируемых параметров, контроль которых может быть разным у различных производителей. Тем не менее, разработаны методы, позволяющие получать силикагель сферической формы с заданным размером пор. Многие марки имеют размер пор 60 Å и обозначаются как «силикагель 60» .
Силикагель имеет весьма высокое сродство к воде и быстро устанавливает с ней равновесие, поэтому результат, получаемый при проведении ТСХ, может в некоторой мере зависеть от влажности в помещении .
Оксид алюминия
Оксид алюминия является полярным неорганическим гидрофильным сорбентом. Его получают, термически удаляя воду из гидратированного гидроксида алюминия . Оксид алюминия для хроматографии обычно нагревают до невысокой температуры, получая материал с удельной поверхностью 50—250 м²/г. Сорбированная вода удаляется при температуре 250 °С .
Модифицированные неподвижные фазы
Силикагель может быть модифицирован тремя типами реакций: этерификацией , взаимодействием с хлорсиланом , содержащим необходимый органический заместитель, или хлорированием с последующей обработкой . Такая модификация приводит к образованию неподвижных фаз с особенными свойствами, которые зависят от природы заместителей и способа их присоединения к силикагелю .
Наиболее распространены обращённые фазы ( англ. reversed phases, RP ), в которых вводимым в силикагель заместителем является алкильная цепь длиной от 2 до 18 атомов углерода. Фазы С2 вытеснили методики импрегнирования силикагеля парафином или силиконовым маслом для последующего использования в обращённо-фазовой хроматографии. Полноценные обращённые фазы содержат цепи С8 или С18. Гидрофильные фазы содержат на поверхности аминогруппы , диольные группы, нитрильные группы и могут быть использованы как в обращённо-фазовой, так и нормально-фазовой хроматографии. В нормально-фазовом режиме они обладают меньшей удерживающей способностью и нечувствительны к влажности. Такие фазы часто обладают особой селективностью за счёт основности аминогрупп или кислотности гидроксильных групп, что позволяет изменять порядок выхода компонентов анализируемой смеси .
Целлюлоза
Первой формой использования целлюлозы в тонкослойной хроматографии была бумажная хроматография . Доступные пластинки для ТСХ и высокопроизводительной ТСХ позволяют разделять смеси полярных веществ, при этом в качестве элюента используются, по крайней мере, тройные смеси из воды, несмешивающегося с ней органического растворителя и водорастворимого растворителя, способствующего образованию одной фазы .
| Сокращение | Значение |
|---|---|
| CHIR | Хиральный слой для разделения энантиомеров |
| CN | Гидрофильный слой с цианогруппами |
| DIOL | Гидрофильный слой с диольной модификацией |
| F | Содержит флуоресцентный индикатор |
| F 254+366 | Длины волн возбуждения флуоресцентного индикатора |
| F 254s | Кислотоустойчивый флуоресцентный индикатор |
| G | Гипс |
| H | Не содержит модификаций |
| NH 2 | Гидрофильный слой с аминогруппами |
| P | Для препаративной работы |
| R | Специально очищенный |
| RP | Обращённая фаза |
| RP-8, RP-18 | Обращённая фаза с 8- или 18-углеродным фрагментом |
| Silanized, RP-2 | Обращённая фаза с диметилсилильной модификацией |
| W | Смачиваемый слой |
| 40, 60,... | Средний размер пор в ангстремах |
Подвижная фаза
Подвижная фаза отвечает за перемещение образца по хроматографической системе, и её правильный выбор важен для получения оптимальных результатов. В качестве подвижной фазы ТСХ позволяет использовать как индивидуальный растворитель, так и сложные смеси. При проведении хроматографии на силикагеле обычно используют смеси органических растворителей. В обращённо-фазовой хроматографии применяют смесь воды с органическим растворителем. В обоих случаях подвижная фаза может быть охарактеризована двумя параметрами: силой растворителя, определяющей степень подвижности компонентов образца по сорбенту, и селективностью, влияющей на порядок зон веществ. Минимальным требованием к подвижной фазе является по крайней мере частичная растворимость в ней образца.
Сила растворителя
Сила растворителя — это параметр, определяющий способность подвижной фазы перемещать вещества по сорбенту. Так, слабый растворитель не способен сдвинуть зону вещества с точки нанесения, а сильный, напротив, смещает зону вещества практически с линией фронта . Подходящий элюент сдвигает вещество примерно на 1/3 от общего расстояния, преодолённого элюентом. В случае силикагеля более сильными являются полярные растворители, а более слабыми — неполярные (эта зависимость отличается для различных сорбентов) .
Количественное описание силы растворителя даётся параметром E° , который может быть определён как адсорбционная энергия растворителя на единицу стандартного сорбента. На практике расстояние, проходимое веществом, не может быть рассчитано на основе данного параметра, однако возможна относительная оценка: при большем значении E° для элюента вещество проходит больший путь, и наоборот. Для обращённых фаз ситуация противоположная. Расстояние миграции зоны вещества связано также с его полярностью: более полярные вещества сильнее взаимодействуют с силикагелем и движутся медленнее, в то время как неполярные проявляют более слабое взаимодействия и мигрируют дальше .
Подходящий элюент определяют экспериментально. Например, образец может быть отхроматографирован в этилацетате . Если сила этилацетата слишком высока, необходимо перейти к менее полярному растворителю или использовать смесь этилацетата с менее полярным растворителем (например, гексаном ). Если же сила растворителя слишком низка, то можно провести эксперимент с более полярным растворителем или повысить силу этилацетата добавлением метанола .
| Растворитель | E° , Al 2 O 3 | Растворитель | E° , Al 2 O 3 | Растворитель | E° , Al 2 O 3 | Растворитель | E° , Al 2 O 3 | Растворитель | E° , Al 2 O 3 |
|---|---|---|---|---|---|---|---|---|---|
| Фторалканы | -0,25 | Бутилхлорид | 0,26 | Диэтилсульфид | 0,38 | Этилацетат | 0,58 | Этанол | 0,88 |
| н -Пентан | 0,00 | Ксилол | 0,26 | Хлороформ | 0,40 | Метилацетат | 0,60 | Метанол | 0,95 |
| Гексан | 0,00 | Диизопропиловый эфир | 0,28 | Дихлорметан | 0,42 | Амиловый спирт | 0,61 | Этиленгликоль | 1,11 |
| Изооктан | 0,01 | 2-Хлорпропан | 0,29 | 0,43 | Диметилсульфоксид | 0,62 | Уксусная кислота | большой | |
| Циклогексан | 0,04 | Толуол | 0,29 | Тетрагидрофуран | 0,45 | Анилин | 0,62 | Вода | большой |
| Циклопентан | 0,05 | 0,30 | Дихлорэтан | 0,49 | Диэтиламин | 0,63 | Соли и буферы | очень большой | |
| 0,06 | Хлорбензол | 0,30 | Метилэтилкетон | 0,51 | Нитрометан | 0,64 | |||
| Пентен-1 | 0,08 | Бензол | 0,32 | 0,53 | Ацетонитрил | 0,65 | |||
| Сероуглерод | 0,15 | Бромэтан | 0,37 | Ацетон | 0,56 | Пиридин | 0,71 | ||
| Тетрахлорметан | 0,18 | Диэтиловый эфир | 0,38 | Диоксан | 0,56 | Пропиловые спирты | 0,82 |
Качество растворителей
В тонкослойной хроматографии существенную роль может играть качество используемых растворителей. Рекомендуется применять растворители по крайней мере аналитической чистоты, поскольку содержащиеся в элюенте примеси могут взаимодействовать с сорбентом или растворённым веществом. Некоторые растворители при хранении подвергаются автоокислению. Растворители при хранении в металлических ёмкостях могут разлагаться или вступать в иные реакции. Значительно влияет на воспроизводимость содержащаяся в растворителе вода, количество которой может меняться со временем, что приводит к изменению силы элюента. Например, кроме иных примесей, хлороформ часто содержит в качестве стабилизатора этанол, даже малые количества которого могут значительно повлиять на результат хроматографии .
Проведение эксперимента
Приготовление образца
Для правильного приготовления образца необходимо выбрать репрезентативную порцию материала. Обычно для этого необходимо полностью растворить его в подходящем растворителе. Иногда растворить весь образец не удаётся: в этом случае необходимо убедиться, что растворены по крайней мере необходимые вещества. Наличие в веществе большого количества примесей или матрицы может ухудшить результаты анализа или разделения, поэтому предварительно может применяться этап очистки образца методами экстракции . Этот шаг реализуется при использовании пластинок с преадсорбционным слоем, который задерживает полярные компоненты матрицы .
По сравнению с колоночной, тонкослойная хроматография менее чувствительна к примесям, поскольку колонки необходимо отмывать перед нанесением новых образцов, а пластинки для ТСХ используются только один раз .
Подготовка пластинок
Иногда перед постановкой ТСХ пластинки подвергают дополнительным этапам подготовки .
- Предварительная отмывка пластинок служит для их очистки от сорбированных примесей и проводится обычно погружением в метанол либо элюированием пустой пластинки в этом элюенте (в последнем случае эффективность отмывки выше).
- Активация предназначена для удаления связанной воды со слоя сорбента. Она проводится путём нагревания пластинок в течение 30 минут при 120 °C (для пластинок с силикагелем). Более сильное и продолжительное нагревание может привести к удалению химически связанной воды и необратимому изменению свойств хроматографического слоя. По сравнению с неактивированными пластинками, активированные пластинки обладают бо́льшими удерживающими свойствами, подвижность веществ на них замедляется.
- Прекондиционирование представляет собой помещение активированной или неактивированной пластинки в атмосферу заданной влажности или газового состава для того, чтобы хроматографический слой сорбировал то или иное количество воды или другого компонента атмосферы (например, паров элюента). Этот процесс неконтролируемо происходит в сосуде для элюирования, содержащем необходимый растворитель, однако существуют приёмы, позволяющие проводить направленную сорбцию на пластинке. Для этого, например, используются насыщенные растворы некоторых солей , атмосфера над которыми имеет определённую влажность.
- Наконец, полезным может оказаться импрегнирование пластинок органическими или неорганическими веществами для изменения сорбционных свойств слоя. Оно проводится погружением, опрыскиванием или предварительным элюированием импрегнирующим раствором. Типичным примером использования импрегнированного силикагеля в тонкослойной хроматографии может служить анализ ненасыщенных органических веществ на силикагеле, содержащем ионы серебра .
Нанесение образца
Нанесение образца на пластинку существенно влияет на качество получаемого результата. Так, разделение компонентов смеси зависит от размеров нанесённой зоны в направлении проведения хроматографии, а сравнивать образцы по их подвижности можно лишь при позиционно точном нанесении зон на пластинку. При проведении количественного анализа необходимо наносить точно измеренные объёмы растворов веществ .
Существует два способа нанесения образца: ручной и автоматический. В случае ручного нанесения на пластинке карандашом отмечают точки, лежащие на отрезке, параллельном нижнему краю пластинки, и отстоящем от него на такое расстояние, чтобы точки не погружались в элюент. Число точек должно быть равно числу анализируемых образцов. Затем на отмеченные точки при помощи микрокапилляров наносят раствор анализируемого образца, объём которого обычно ограничен 5 мкл в случае ТСХ и 1 мкл в случае высокопроизводительной ТСХ. Большие объёмы растворов наносят несколькими касаниями, высушивая между ними пластинку от растворителя. При этом растворитель, в котором находится образец, должен иметь как можно меньшую полярность, поскольку при нанесении происходит круговая хроматография, которая может приводить к распространению и разделению компонентов образца .
Автоматические и полуавтоматические системы для нанесения образцов используют принцип спрея. Раствор набирается в иглу шприца, игла затем точно позиционируется над поверхностью пластинки, и поршень выдавливает заданный объём раствора. Растворитель удаляется путём обдувания сжатым воздухом или азотом. Технология позволяет создавать узкие зоны веществ, что способствует максимальному разрешению. Нанесение веществ возможно также в виде точек либо прямоугольных зон, а наносимые объёмы могут варьироваться от нескольких нанолитров для высокопроизводительной ТСХ до сотен микролитров для препаративной ТСХ. В последнем случае техника позволяет создать однородную вытянутую зону вдоль всей пластинки .
Элюирование
После нанесения раствора исследуемой смеси веществ пластинка помещается в сосуд, в котором на дне налит слой элюента. При погружении нижнего края пластины в жидкость элюент под действием капиллярных сил начинает подниматься вверх по хроматографическому слою. Чтобы избежать испарения летучего элюента с поверхности пластинки в процессе хроматографирования, сосуд герметизируют. После того, как линия фронта достигнет достаточной для анализа высоты, пластинку извлекают и высушивают. Расстояние, проходимое линией фронта, принято отсчитывать от линии старта. Его выбирают достаточным для последующей идентификации разделённых веществ на поверхности пластинки. Разделение компонентов смеси улучшается с увеличением этого расстояния, но существует оптимальное значение, которое для обычных пластин составляет 12—15 см. Это обусловлено тем, что капиллярные силы действуют на линии фронта смачивания, и подвижная фаза по мере продвижения по хроматографическому слою испытывает всё меньшее воздействие капиллярных сил из-за уравновешивания их силой тяжести.
При проведении хроматографии для продвижения фронта на оптимальную длину требуется, в зависимости от вязкости элюента, от 45 до 150 минут. В высокопроизводительной ТСХ упаковка частиц хроматографического слоя плотнее, оптимальная дистанция составляет приблизительно 6 см, а элюирование занимает от 15 до 50 минут .

Существуют различные способы элюирования образцов на пластинках. Наиболее распространён способ с вертикальной пластинкой и поднимающимся элюентом: он даёт приемлемые результаты для большинства целей. Существуют также сосуды, позволяющие направлять подвижную фазу горизонтально. Результаты в этом случае сравнимы со стандартными, но преимущество состоит в том, что подавать элюент можно одновременно в двух встречных направлениях, что позволяет удвоить число образцов (на высокопроизводительной пластине размером 20×10 см можно разделить одновременно 72 образца). Круговая и антикруговая хроматография, при которой движение элюента происходит от центра к периферии или наоборот, применяется весьма ограниченно, например, при подборе растворителя для хроматографии .
Многократное элюирование применяется, когда однократное не позволяет эффективно разделить компоненты смеси. При повторном элюировании в одной и той же системе растворителей оптимизация происходит за счёт концентрирования неправильно нанесённых зон веществ. Можно также предварительно провести элюирование в очень полярном растворителе в течение небольшого времени, что позволит сконцентрировать вещества на слое. Предварительное элюирование в неполярном растворителе позволяет удалить неполярную матрицу из объекта .
Двумерное элюирование содержит два последовательных элюирования в перпендикулярных направлениях. После первого элюирования пластинка извлекается, просушивается, и линия, на которой расположились разделённые компоненты, становится линией старта во втором элюировании. При этом можно пользоваться двумя элюентами различной силы, а также одним и тем же элюентом, что полезно для оценки устойчивости вещества в хроматографическом эксперименте .
Визуализация

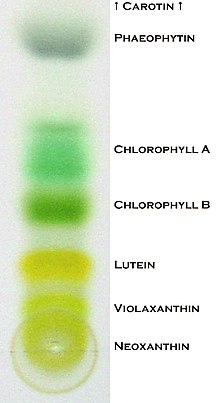
После элюирования разделяемые вещества смеси оказываются расположенными на поверхности пластинки в определённых положениях. Для определения их положений на пластинке предложен ряд методов. Если вещество окрашено, то положение пятна определяют визуально невооруженным глазом, какая-либо дополнительная обработка реактивами или визуализация иными методами не требуется. Однако большинство органических соединений бесцветны. Если вещество поглощает в ультрафиолетовой области, то оно визуализируется на пластинке с флуоресцентным индикатором F 254 под ультрафиолетовым излучением (пятна таких веществ на пластинке выглядят либо тёмными, либо флуоресцирующими) .
Широко применяются более или менее селективные химические методы визуализации, в которых реагент или раствор, который используется для визуализации, называют проявителем . Например, простейший метод заключается в обработке парами иода , при этом сорбированные вещества становятся тёмно-коричневыми, а фон остаётся светлым. Универсальные методы основаны на применении растворов различных кислот или окислителей , при нагревании с которыми вещества определённых классов образуют коричневые или чёрные пятна. Селективные реагенты, например, нингидрин , позволяют визуализировать соединения конкретного класса — амины и аминокислоты .
Другим проявителем для обнаружения аминов и алкалоидов служит реактив Драгендорфа .
Хроматографические тонкослойные пластинки также могут быть использованы в биологических тестах для выявления веществ с биологической активностью к микроорганизмам методом посева культур микроорганизмов в питательной среде на пластины .
Оценка результатов
Визуальное сравнение подвижности и характера визуализации (цвета, флуоресценции) образца и неких стандартов даёт информацию о природе анализируемого вещества, а интенсивность зоны характеризует его количество. Вещества могут также быть смыты с хроматографического слоя для дальнейшего анализа другими методами. Количественная оценка в высокопроизводительной ТСХ проводится по цифровым изображениям после проведения эксперимента согласно стандартизированным методикам. даёт информацию о спектральных свойствах веществ на пластинке. Для повышения точности анализа применяется сравнение спектров с записями баз данных, а также масс-спектрометрия разделённых веществ. Количественная оценка также проводится при помощи сканирующего денситометра .
Теория тонкослойной хроматографии
Поток растворителя
Поток подвижной фазы через слой в тонкослойной хроматографии вызван действием капиллярных сил. Движение фронта жидкости можно описать квадратичной зависимостью:
где z f — расстояние от линии погружения до линии фронта, t — время элюирования, а ϰ — постоянная потока, или коэффициент скорости. Эта зависимость была установлена в 1856 г. инженером Анри Дарси , который исследовал скорость проникновения почвенных вод через пористую поверхность. Уравнение показывает, что скорость миграции фронта гиперболически убывает с увеличением пути миграции. Так, например, при заданном значении ϰ = 3,3 см²/с миграция фронта на 10 см занимает 30 минут, а на 15 см — 68 минут . Постоянная потока ϰ определяется диаметром частиц сорбента, а также отношением поверхностного натяжения элюента к его вязкости . Сорбированная на слое вода часто связывается со слоем более сильно, чем компоненты элюента. В таком случае попавшая в слой вода снижает пористость слоя и увеличивает скорость прохождения элюента. Если сила элюента и воды сопоставима, то элюент вытесняет воду из слоя .
Изотерма сорбции

Любой хроматографический процесс основан на перераспределении вещества между подвижной и неподвижной фазами. Это равновесие связано с температурой, причём при её повышении доля вещества в подвижной фазе обычно увеличивается. Для численного описания равновесия вводятся коэффициенты перераспределения:
где С s и С m — концентрации вещества в сорбирующей и несорбирующей фазах, соответственно. Коэффициент перераспределения определяет угол наклона изотермы сорбции — линейного графика зависимости между С s и С m при постоянной температуре. Интерес представляет случай искривлённой изотермы сорбции: в этом случае наклон кривой зависит от концентрации, и пятна на хроматограмме размываются. Для вогнутой изотермы сорбции (где K снижается при увеличении концентрации вещества) у пятна образуется «хвост». При выпуклой изотерме сорбции наблюдается противоположная ситуация: размывается передняя часть пятна . Подобные эффекты объясняются кинетическими процессами (т. н. сопротивлением массопередаче) или нелинейным характером изотермы сорбции («перегрузкой»). В сложных смесях компоненты могут влиять друг на друга и создавать условия взаимной перегрузки. В этом случае К снижается . Как правило, в аналитических приложениях нелинейность изотерм сорбции нежелательна, поскольку она приводит к размытию зон и изменению подвижностей пятен. Спрямление изотерм может быть достигнуто путём дезактивации сорбента (например, при добавлении воды или при повышении элюирующей силы растворителя). В этом случае наиболее активные сорбционные центры занимаются дезактивирующими добавками, и сорбирующий слой становится более однородным .
Положение зон на пластинке

Обычным и самым простым параметром, описывающим положение зоны вещества на пластинке, является фактор удерживания:
где z x — расстояние, пройденное зоной, а z f – z 0 — расстояние от линии старта до фронта растворителя. Этот параметр легко измеряется, однако он не содержит информации об условиях хроматографического процесса. По этой причине предложены другие определения данного параметра R f ' как относительного времени пребывания вещества в подвижной фазе либо доли молекул сорбата в подвижной фазе и др. Вычисляемое значение фактора удерживания всегда меньше единицы, поэтому для удобства введён параметр hR f , который всегда выражается целым числом и используется для количественного описания положения зоны на пластинке :
Как правило, расстояние, пройденное веществом, измеряют от точки старта до середины зоны вещества. Такой метод подходит для зон небольшого размера, однако в анализах чистоты фармацевтических препаратов, где загрузка вещества достигает 1000 мкг на точку, пятна часто уширяются настолько, что колебания значений hR f могут достигать 18 единиц. Кроме того, если рядом с такой точкой элюировать образец с гораздо более низкой концентрацией, то центр получившейся точки небольшого размера вряд ли точно совпадёт с центром уширенной зоны. Поэтому значение hR f иногда дают в виде интервала, охватывающего значения от нижней части зоны до её верхней части . Принципиально иным параметром является значение R st , вычисляемое как частное от деления пути, пройденного веществом, на путь, пройденный некоторым эталонным веществом. В настоящее время этот параметр практически утратил своё значение .
Параметры разделения

Чтобы чётко описать степень разделения двух веществ, в тонкослойной хроматографии вводится параметр разрешающей способности R s , определяемой как частное от деления расстояния между центрами двух пятен z x2 — z x1 на ширину хроматографического пика:
Из уравнения видно, что чем выше расстояние между центрами пятен, тем разделение лучше, а чем шире пятна (соответственно, больше параметр σ — среднеквадратическое отклонение ), тем вещества разделены хуже. При R s = 0,5 расстояние между пятнами составляет σ 1 + σ 2 ≈ 2σ, то есть в данном случае происходит «разделение на 2σ» и перекрывается 20 % площади двух зон. При разделении на 4σ перекрывается лишь 3 % площади .
Применение
Выделяют три основных области применения тонкослойной хроматографии .
- Демонстрация основ хроматографии, быстрые предварительные эксперименты для оптимизации препаративных хроматографических разделений.
- Исследовательские инструменты в фундаментальной и прикладной науке, используемые для изучения большого числа образцов; комбинация планарного разделения с биологической, спектроскопической и масс-спектрометрической детекцией (в качестве замены методу колоночной хроматографии).
- Идентификация медицинских и пищевых растительных компонентов по валидированным методикам с повышенными требованиями к точности, воспроизводимости и чувствительности.
Примечания
- Schoenbein C. F. Verhl. Naturforsh. Ges. Basel, 3, 249 (1861)
- , с. 15.
- ↑ , с. 17—20.
- , с. 20.
- , p. 1.
- ↑ , p. 2—5.
- , с. 375—377.
- , p. 19.
- См. раздел
- ↑ , p. 5—7.
- ↑ , p. 7—9.
- , p. 41—49.
- ↑ , p. 9—12.
- ↑ , p. 12—14.
- , p. 14—16.
- , с. 39—42.
- , с. 45—52.
- , с. 61.
- ↑ , с. 146—151.
- , с. 152—153.
- ↑ , p. 4—6.
- , с. 203—205.
- , p. 2.
Литература
Книги
- Гейсс Ф. Основы тонкослойной хроматографии (планарная хроматография) = Fundamentals of Thin Layer Chromatography (Planar Chromatography) / Пер. с англ. М. А. Кошевник и Б. Н. Лапина, под ред. В. Г. Берёзкина. — 1988. — Т. 1.
- Гейсс Ф. Основы тонкослойной хроматографии (планарная хроматография) = Fundamentals of Thin Layer Chromatography (Planar Chromatography) / Пер. с англ. М. А. Кошевник и Б. Н. Лапина, под ред. В. Г. Берёзкина. — 1988. — Т. 2.
- Кирхнер Ю. Тонкослойная хроматография / Пер. с англ. Д. Н. Соколова и М. И. Яновского, под ред. В. Г. Берёзкина. — М. : Мир, 1981. — Т. 1. — 616 с. — 5000 экз.
- Hahn-Deinstrop E. . — 2nd Ed. — Wiley, 2007. — ISBN 978-3-527-31553-6 .
- Reich E., Widmer V. Thin Layer Chromatography // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2012. — doi : .
Обзоры
- Cheng S.-C., Huang M.-Z., Shiea J. Thin layer chromatography/mass spectrometry (англ.) // Journal of Chromatography A. — 2011. — Vol. 1218, no. 19 . — P. 2700—2711. — doi : . — .
- Del Bubba M., Checchini L., Lepri L. Thin-layer chromatography enantioseparations on chiral stationary phases: a review (англ.) // Analytical and Bioanalytical Chemistry. — 2013. — Vol. 405, no. 2—3 . — P. 533—554. — doi : . — .
- Fuchs B., Süss R., Teuber K., Eibisch M., Schiller J. Lipid analysis by thin-layer chromatography — A review of the current state (англ.) // Journal of Chromatography A. — 2011. — Vol. 1218, no. 19 . — P. 2754—2774. — doi : . — .
- Morlock G., Schwack W. Coupling of planar chromatography to mass spectrometry (англ.) // TrAC Trends in Analytical Chemistry. — 2010. — Vol. 29, no. 10 . — P. 1157—1171. — doi : .
- Poole C. F. Planar chromatography at the turn of the century (англ.) // Journal of Chromatography A. — 1999. — Vol. 856, no. 1—2 . — P. 399—427. — doi : . — .
- Poole S. K., Poole C. F. High performance stationary phases for planar chromatography (англ.) // Journal of Chromatography A. — 2011. — Vol. 1218, no. 19 . — P. 2648—2660. — doi : .
- Rabel F., Sherma J. (англ.) // LCGC North America. — 2012. — Vol. 30, no. 6 . — P. 458—473.
- Renger B., Végh Z., Ferenczi-Fodor K. Validation of thin layer and high performance thin layer chromatographic methods (англ.) // Journal of Chromatography A. — 2011. — Vol. 1218, no. 19 . — P. 2712—2721. — doi : . — .
- Sherma J. Review of advances in the thin layer chromatography of pesticides: 2010-2012 (англ.) // Journal of Environmental Science and Health, Part B: Pesticides, Food Contaminants, and Agricultural Wastes. — 2013. — Vol. 48, no. 6 . — P. 417—430. — doi : . — .
- 2021-11-13
- 1