Машков, Владимир Львович
- 1 year ago
- 0
- 0

Нитроалканы (нитропарафины) — это производные алканов , в молекулах которых один или несколько атомов водорода замещены на . Относятся к классу нитросоединений .
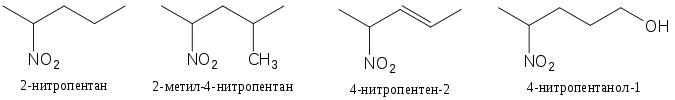
Названия нитроалканов образуются из названия соответствующего углеводорода с префиксом «нитро-» и с учётом числа нитрогрупп в молекуле вещества. Нумерация углеродной цепи начинается с конца цепи, к которому нитрогруппа находится ближе, если в цепи нет иных, более старших характеристических групп и заместителей (-OH, -NH 2 , -SO 3 H), двойных или тройных связей.
Низшие нитроалканы при нормальных условиях представляют собой бесцветные или желтоватые жидкости со слабым запахом, нитроалканы с большой длиной углеродной цепи или с несколькими нитрогруппами в молекуле — кристаллические вещества.
Наличие полярной нитрогруппы обусловливает значительный дипольный момент молекул мононитроалканов — (10,5÷12,6)•10 -30 Кл•м (3,15÷3,70 D). В УФ-спектрах нитроалканов наблюдается слабое поглощение в области 270—280 нм с ε~10÷15, вызванное n→π* переходом от неподелённой электронной пары атома кислорода нитрогруппы на несвязывающую молекулярную орбиталь. Сильное поглощение, вызванное π→π* переходом с ε~5000, находится в области 200 нм. В ИК-спектрах максимумы поглощения находятся в областях 1370 см -1 , 1550 см -1 и связаны с симметричными и антисимметричными колебаниями двух N-O связей.
Кроме реакций, характерных для алканов вообще, нитроалканы характеризуются реакциями по нитрогруппе и реакциями по α-углеродному атому.
Восстановление нитроалканов осуществляют действием восстановителей либо электрохимическим способом. Процесс восстановления включает несколько стадий:
Присоединение одного электрона с образованием анион-радикала и быстрое присоединение второго электрона с образованием дианиона
Протонирование дианиона с последующим образованием нитрозосоединения :
При наличии α-углеродного класса возможна перегруппировка нитросоединения в оксим:
Реакция первичных нитроалканов с 80-95 % серной кислотой приводит к образованию карбоновой кислоты и соли гидроксиламина :
Эта реакция используется в промышленном синтезе гидроксиламина.
Нитроалканы с первичной и вторичной нитрогруппой являются CH-кислотами, по силе сравнимыми с фенолами , при этом наличие у одного атома двух и трёх нитрогрупп сильно увеличивает кислотность: если у нитрометана CH 3 NO 2 pK a (H 2 O) = 10,2, то у pK a (H 2 O) ~ 0.
Кислотность нитроалканов может также обусловливаться их таутомеризацией (равновесие сильно сдвинуто влево) в нитроновые кислоты (кислоты средней силы с pK a ~3):
Реакция протекает по α-углеродному атому в присутствии оснований.
Галогенирование:
Нитрозирование:
Алкилирование:
Нитрометан используется как растворитель, сырьё для органического синтеза, служит топливом для реактивных двигателей. Тетранитрометан — окислитель во взрывотехнике и в ракетной отрасли. — сырьё в синтезе капролактама .