Органические дисульфиды
- 1 year ago
- 0
- 0

Органические дисульфиды — сераорганические соединения общего состава R-S-S-R', которые содержат в молекулах два атома серы, связанных друг с другом. Дисульфиды могут рассматриваться как органические производные дисульфана H 2 S 2 .
Название органических дисульфидов образуется как из названий углеводородных остатков, присоединённых к атомам серы дисульфидной группы, так и из названия алкана, два соседних атома углерода которого замещены на атомы серы, с приставкой дитиа- .
Кроме ациклических дисульфидов существуют также моноциклические и полициклические дисульфиды. Первые называются дитиациклоалканами, вторые — эпидитиациклоалканами.
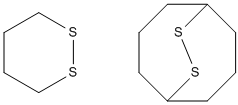
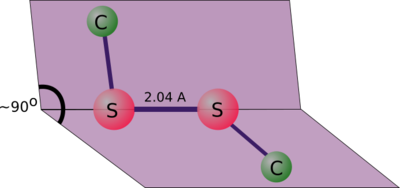
Молекулы дисульфидов имеют зигзагообразную форму, а двугранный угол R-S-S-R равен ~90° (80-100°). Связь S-S (энергия диссоциации 276 кДж/моль) прочнее связей O-O (200 кДж/моль), Se-Se (190 кДж/моль), что объясняется вкладом p-π- и d-π-взаимодействий. Однако S-S связь способна разрываться при действии УФ-облучения с образованием тиильных радикалов :
В УФ-спектрах дисульфидов максимум поглощения наблюдается в области 240—280 нм, в ИК-спектрах валентные колебания связи S-S находятся в области 470—503 см -1 . В ЯМР-спектре диметилдисульфида химический сдвиг протонов метильной группы находится в области 2 м.д.
Низшие алифатические дисульфиды представляют собой жидкости с отвратительным запахом и высокими температурами кипения. Растворимы в органических растворителях, нерастворимы в воде.
Химические свойства органических дисульфидов проистекают из непрочности связи S-S. Дисульфиды способны превращаться в тиолы с разрывом дисульфидной связи при действии восстановителей (гидриды металлов, гидросульфит натрия ):
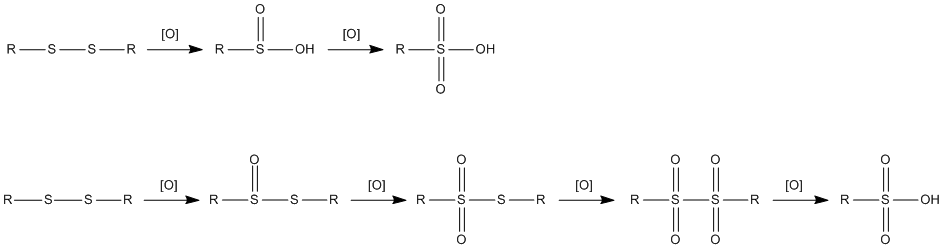
При действии сильных окислителей дисульфиды окисляются до сульфиновых кислот и сульфокислот . Мягкие окислители последовательно окисляют дисульфиды до тиолсульфинатов, тиолсульфонатов, дисульфонов и сульфокислот:
При действии галогенов и сульфурилгалогенидов также происходит окислительное расщепление дисульфидной связи:
Синтез органических дисульфидов можно осуществлять несколькими способами.
При фотолизе тиолов образуются соответствующие дисульфиды. При фотолизе тиолов в смеси с дисульфидами получаются смешанные дисульфиды:
Действие мягких окислителей ( иод , пероксид водорода , трихлорид железа и др.) на тиолы приводит к дисульфидам:
Тиолы окисляются в дисульфиды также при окислении кислородом воздуха в присутствии ионов металлов переменной валентности в качестве катализаторов, действии УФ-излучения и :
Реакция серы с натрием и алкилиодидами в жидком аммиаке является одним из препаративных методов:
Реакция серы с алкилгалогенидами в присутствии алкоксидов:
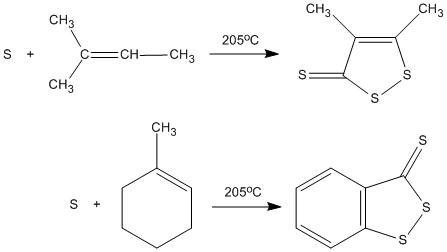
Нагревание серы с ненасыщенными углеводородами позволяет получать циклические дисульфиды наряду со смесью других серосодержащих продуктов:
Разложение тиоцианатов в щелочной среде:
Реакция тиол-дисульфидного обмена в присутствии триэтиламина :
Органические дисульфиды применяются в органическом синтезе, для получения красителей, лекарственных средств и пестицидов. Некоторые дисульфиды используются для ускорения вулканизации каучуков, как регуляторы радикальной полимеризации.