Interested Article - Гем а

- 2020-06-20
- 1
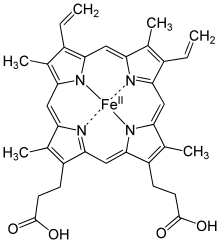
Гем а — вид гема , координационный комплекс макроциклического лиганда порфирина и атома железа .
Связь с другими гемами
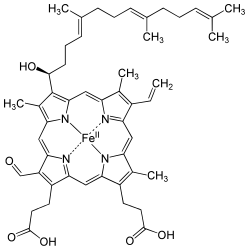
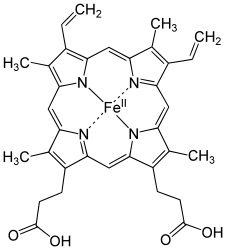
Гем а отличается от гема В тем, что его боковая метильная цепь в восьмой позиции окислена до альдегидной группы, а гидроксиметилфарнезильная группа присоединена к боковой винильной цепи в позиции три. Гем а похож по строению на гем О : оба содержат фарнезеновый радикал в позиции три, но у гем а О нет альдегидной группы, вместо неё он сохраняет метильную. Точная структура гема а , основанная на исследовании восстановленного гема с Fe(II) методом ядерного магнитного резонанса и инфракрасной спектроскопии , была опубликована в 1975 году .
История
Гем а был впервые изолирован немецким биохимиком Отто Варбургом в 1951 году. Им же было доказано, что он является активным компонентом встроенного в мембрану металлопротеина цитохром c-оксидазы .
Стереохимия
До последнего времени вопрос о полной химической структуре гема а был не разрешён, до конца оставалось неясным геометрическое положения атома углерода в 3-й позиции кольца I. Недавно было опубликовано исследование, установившее его принадлежность к хиральной S-конфигурации .
Как и гем b , гем а обычно связан с через координационные связи между гемом железа и боковыми цепочками аминокислот. Он содержится в гемоглобине , миоглобине , а также в важном ферменте дыхательной цепи — цитохром с-оксидазе .

Гем
а
в цитохром-оксидазе с(ЦСО) крепится двумя боковыми
гистидиновыми
цепочками (показаны розовым)
Примером металлопротеина , содержащего гем а , является цитохром с-оксидаза . Этот очень сложный белок содержит гем а на двух сайтах, выполняющих различные функции. Железо гема а в шестикоординированно, поскольку связано с шестью другими атомами, а в оно соединено только с пятью атомами, что делает шестую связь доступной для связывания с молекулярным кислородом . Кроме того, фермент несёт на себе три иона меди и несколько ионов калия и натрия. Полагают, что оба гема А в ЦСО с лёгкостью обмениваются электронами между собой, а также с ионами меди и близко расположенным цитохромом с .
Согласно современным представлением две формильные группы и изопреноидная боковая цепь играют важную роль в сохранении энергии восстановления кислорода цитохром с-оксидазой . ЦСО, по-видимому, ответственна за сохранение этой энергии и перекачку протонов во внутримитохондриальное пространство .
См. также
- Гемопротеин
- Цитохром с-оксидаза (IV комплекс цепи клеточного дыхания )
Источники
- Caughey, W.S. et al. (англ.) // Journal of Biological Chemistry : journal. — 1975. — Vol. 250 . — P. 7602—7622 . 29 марта 2017 года.
- Warburg, O and Gewitz H S. Cytohämin aus Herzmuskel (неопр.) // . — 1951. — Т. 288 . — С. 1—4 . — doi : .
- Yamashita E., Aoyama H., Yao M., Muramoto K., Shinzawa-Itoh K., Yoshikawa S., Tsukihara T. Absolute configuration of the hydroxyfarnesylethyl group of heme A, determined by X-ray structural analysis of bovine heart cytochrome c oxidase using methods applicable at 2.8 Angstrom resolution (англ.) // : journal. — International Union of Crystallography , 2005. — Vol. 61 , no. 10 . — P. 1373—1377 . — doi : .
- Tsukihara T., Shimokata K., Katayama Y., Shimada H., Muramoto K., Aoyama H., Mochizuki M., Shinzawa-Itoh K., Yamashita E., Yao M., Ishimura Y., Yoshikawa S. The low-spin heme of cytochrome c oxidase as the driving element of the proton-pumping process (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2003. — Vol. 100 , no. 26 . — P. 15304—15309 . — doi : . — . — PMC .
- ↑ Yoshikawa, S.; Shinzawa-Itoh, K.; Nakashima, R.; Yaono, R.; Yamashita, E.; Inoue, N.; Yao, M.; Fei, M. J.; Peters Libeu, C. Redox-Coupled Crystal Structural Changes in Bovine Heart Cytochrome c Oxidase (англ.) // Science : journal. — 1998. — Vol. 280 , no. 5370 . — P. 1723—1729 . — doi : . — .
- Shimokata K., Katayama Y., Murayama H., Suematsu M., Tsukihara T., Muramoto K., Aoyama H., Yoshikawa S., Shimada H. The proton pumping pathway of bovine heart cytochrome c oxidase (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — Vol. 104 , no. 10 . — P. 4200—4205 . — doi : . — . — PMC .
- 2020-06-20
- 1