Interested Article - Двухэлектронная трёхцентровая связь

- 2021-07-13
- 1

Двухэлектронная трёхцентровая связь — одна из возможных электроно-дефицитных связей. Характерна тем, что пара валентных электронов локализована в пространстве сразу трёх атомов (отсюда и понятие «электроно-дефицитности» — «нормальным» случаем является двухэлектронная двухцентровая связь). Общее описание механизма образования электронодефицитных связей даётся в рамках теории молекулярных орбиталей (модель «несвязывающих» орбиталей). Проблема дефицита электронов отпадает в кольцегранной модели Снельсона-Кушелева.
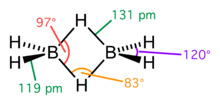
Наибольший вклад в развитие теории трёхцентровых двухэлектронных связей был сделан при изучении бороводородов и борорганических соединений, где подобное связывание реализуется очень часто (например, в диборане ).
Возможны и другие электронодефицитные связи, с другим соотношением валентных электронов и связанных атомов. Подобное связывание часто реализуется в металлорганических соединениях .
Ссылки
|
|
В статье
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
- 2021-07-13
- 1