Interested Article - ЯМР-спектроскопия

- 2021-03-01
- 1
Спектроскопи́я я́дерного магни́тного резона́нса, ЯМР-спектроскопия — исследования химических объектов, использующий явление ядерного магнитного резонанса . Явление ЯМР открыли в 1946 году американские физики Феликс Блох и Эдуард Пёрселл . Наиболее важными для химии и практических применений являются спектроскопия протонного магнитного резонанса (ПМР-спектроскопия), а также спектроскопия ЯМР на ядрах углерода-13 ( 13 C ЯМР-спектроскопия ), фтора-19 ( ), фосфора-31 ( ). Если элемент обладает нечетным порядковым номером или изотоп какого-либо (даже четного) элемента имеет нечетное массовое число, ядро такого элемента обладает спином, отличным от нуля. Некоторые ядра, имеющие четный спин, например, равный 2, также могут иметь хорошо детектируемые сигналы спектра ЯМР (например Cl-36 , ). Из возбужденного состояния в нормальное ядра могут возвращаться, передавая энергию возбуждения окружающей среде-«решетке», под которой в данном случае понимаются электроны или атомы другого сорта, чем исследуемые. Этот механизм передачи энергии называют спин-решёточной релаксацией , его эффективность может быть охарактеризована постоянной T 1 , называемой временем спин-решёточной релаксации.
Подобно инфракрасной спектроскопии , ЯМР выявляет информацию о молекулярном строении химических веществ. Однако, он обеспечивает более полную информацию, чем ИС, позволяя изучать динамические процессы в образце — определять константы скорости химических реакций, величину энергетических барьеров внутримолекулярного вращения. Также ЯМР позволяет записывать спектры промежуточных частиц химических реакций .
Эти особенности делают ЯМР-спектроскопию удобным средством как в теоретической органической химии, так и для анализа биологических объектов .
Базовая ЯМР техника

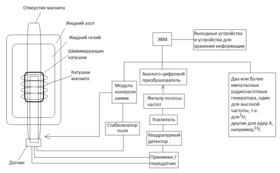
Образец вещества для ЯМР помещается в тонкостенную стеклянную трубку (ампулу). Когда её помещают в магнитное поле, ЯМР активные ядра (такие как 1 H или 13 C) поглощают электромагнитную энергию. Резонансная частота , и интенсивность испущенного сигнала пропорциональны силе магнитного поля . Так, в поле в 21 Тесла протон резонирует при частоте 900 МГц.
Химический сдвиг
В зависимости от локального электронного окружения разные протоны в молекуле резонируют на отличающихся частотах. Так как и это смещение частоты, и основная резонансная частота прямо пропорциональны величине индукции магнитного поля, то это смещение преобразуется в независимую от магнитного поля безразмерную величину, известную как химический сдвиг. Химический сдвиг определяется как изменение относительно некоторых эталонных образцов. Величина частотного сдвига экстремально мала в сравнении с базовой частотой ЯМР спектрометра. Типичный сдвиг частоты равен 100 Гц, тогда как базовая ЯМР частота имеет порядок 100 МГц. Таким образом, с учетом различий базовых частот спектрометра, химический сдвиг часто выражается в безразмерных единицах миллионных долей (м.д. или англ. - ppm).
Так как величина химического сдвига зависит от состава вещества, она используется для получения предварительной информации о химической структуре молекул в образце. К примеру, спектр этанола (CH 3 CH 2 OH) дает 3 разрешенных сигнала и имеет 3 отличных величины химических сдвигов: одна для группы CH 3 , вторая для СН 2 -группы и последняя для OH. Типичный сдвиг для CH 3 -группы находится в области 1 ppm, для CH 2 -группы присоединенной к OH — 4 ppm и OH примерно 2—3 ppm. Таким образом, зная величины химических сдвигов можно определить, какие группы атомов входят в состав молекул образца.
Из-за внутримолекулярного движения при комнатной температуре сигналы ЯМР 3 метиловых протонов усредняются в течение процесса регистрации сигналов, который длится лишь несколько миллисекунд. Все протоны метиловой группы вырождаются и формируют сигналы с эквивалентным химическим сдвигом. Программное обеспечение спектрометров ЯМР позволяет оценить интегральную интенсивность сигналов ЯМР для того, чтобы понять, количество протонов дающих вклад в наблюдаемый сигнал.
Спин-спиновое взаимодействие
Наиболее полезную информацию для определения структуры в одномерном ЯМР-спектре даёт так называемое спин-спиновое взаимодействие между активными ЯМР ядрами. Это взаимодействие возникает в результате переходов между различными спиновыми состояниями ядер в химических молекулах , что приводит к расщеплению сигналов ЯМР. Это расщепление может быть простым и сложным и, как следствие, его либо просто интерпретировать, либо оно может запутать экспериментатора.
Это связывание обеспечивает детальную информацию о связях атомов в молекуле.
Взаимодействие второго порядка (сильное)
Простое спин-спиновое взаимодействие предполагает, что константа взаимодействия мала в сравнении с разницей в химических сдвигах между сигналами. Если разность сдвигов уменьшается (или константа взаимодействия увеличивается), интенсивность мультиплетов образцов искажается, становится более сложной для анализа (особенно если система содержит более 2 спинов). Однако в мощных ЯМР-спектрометрах искажения обычно умеренные и это позволяет легко интерпретировать связанные пики.
Эффекты второго порядка уменьшаются с увеличением разницы частоты между мультиплетами, поэтому высокочастотный ЯМР спектр показывает меньшее искажение, чем низкочастотный спектр.
Приложение ЯМР спектроскопии к исследованию белков
Большинство последних инноваций в ЯМР спектроскопии сделаны в так называемой ЯМР спектроскопии белков, которая становится очень важной техникой в современной биологии и медицине. Общей задачей является получение 3-мерной структуры белка в высоком разрешении, подобно изображениям, получаемым в рентгеновской кристаллографии. Из-за присутствия большего числа атомов в белковой молекулe в сравнении с простым органическим соединением, базовый 1 H спектр переполнен перекрывающимися сигналами, поэтому прямой анализ спектра становится невозможным. Поэтому были разработаны многомерные техники, чтобы решить эту проблему.
Чтобы улучшить результаты этих экспериментов, применяют метод меченых атомов, используя 13 С или 15 N. Таким образом становится возможным получить 3D-спектр белкового образца, что стало прорывом в современной фармацевтике. В последнее время получают распространение методики (имеющие как преимущества, так и недостатки) получения 4D-спектров и спектров большей размерности, основанные на методах нелинейного семплирования с последующим восстановлением сигнала спада свободной индукции с помощью специальных математических методик.
Количественный анализ методом ЯМР
При количественном анализе растворов площадь пика может быть использована как мера концентрации в методе или методе добавок. Известны также методики, в которых градуированный график отражает концентрационную зависимость химического сдвига. Применение метода ЯМР в неорганическом анализе основано на том,что в присутствии парамагнитных веществ происходит ускорение времени ядерной релаксации. Измерение скорости релаксации может быть выполнено несколькими методами.Надежным и универсальным является, например, импульсивный вариант метода ЯМР, или, как его обычно называют, . При измерениях по этому методу на исследуемый образец в магнитном поле через определенные промежутки времени накладывают кратковременные радиочастотные импульсы в области резонансного поглощения.В приемной катушке появляется сигнал спинового эха, максимальная амплитуда которого связана с временем релаксации простым соотношением. Для проведения обычных аналитических определений нет необходимости находить абсолютные значения скоростей релаксации . В этих случаях можно ограничиться измерением какой-либо пропорциональной им величины, например амплитуды сигнала . Измерение амплитуды может быть выполнено на простой, более доступной аппаратуре. Существенным достоинством метода ЯМР является широкий интервал значений измеряемого параметра. С помощью установки спинового эха можно определять время релаксации от 0,00001 до 100 с. с погрешностью 3...5%. Это позволяет определять концентрацию раствора в очень широком интервале от 1...2 до 0,000001...0000001 моль/л.Наиболее часто используемым аналитическим приемом является метод градуировочного графика.
См. также
Примечания
- Tarasov V., Guerman K., Simonoff G., Kirakosyan G., Simonoff M. . — Paris: IAEA, 2000.
- Тарасов В.П. Киракосян Г.А., Герман К.Э. [ 36Cl-NMR Parameters for Molten Salt Reprocessing Analyses:Quadrupole Moment, Spin-Lattice Relaxation and SternheimerAntishielding Factor for Chloride and Perchlorate Ion (4) (PDF) Spin-lattice relaxation and quadrupole moment of the isotope 36CI. Available from: [accessed Jul 07 2023].] (рус.) // Доклады Академии наук , сер. физическая химия : журнал. — 1999. — April ( т. 368 ). — С. 287 - 292 . 7 июля 2023 года.
- ↑ Полищук В. Р. Как разглядеть молекулу. - М., Химия, 1979. - Тираж 70000 экз. - С. 197-242
Литература
- Гюнтер X. Введение в курс спектроскопии ЯМР. — Пер. с англ. — М. , 1984.
- Абрагам А. Ядерный магнетизм. — М.: ИЛ. — 1963. — 630 с.
- Сликтер Ч . Основы теории магнитного резонанса. — М.: Мир.- 1981. — 448 с.
- Фаррар Т., Беккер Э . Импульсная и Фурье спектроскопия ЯМР. — М.: Мир.- 1973.
- Хеберлен У., Меринг М. ЯМР высокого разрешения в твердых телах. — М.: Мир.- 1980.
- Лундин А. Г., Федин Э. И. ЯМР-спектроскопия. — М.: Наука.- 1980.
- Габуда С. П., Плетнев Р. Н., Федотов М. А. Ядерный магнитный резонанс в неорганической химии.- М: Наука.- 1988.- 214 с.
- Габуда С. П., Лундин А. Г. Внутренняя подвижность в твердом теле. — Новосибирск: Наука.- 1986. — 176 с.
- Габуда С. П., Ржавин А. Ф. Ядерный магнитный резонанс в кристаллогидратах и гидратированных белках. — Из-во: Наука. Новосибирск. — 1978.- 160 с.
- Сергеев Н. А., Рябушкин Д. С. Основы квантовой теории ядерного магнитного резонанса.- М.: Логос.- 2013.- 270 с.
- Ершов Б. А., Спектроскопия ЯМР в органической химии. — Учебное пособие для вузов. — Из-во: СПбГу — 1995. — 263с.
- Ионин Б. И., Ершов Б. А., Кольцов А. И., ЯМР-спектроскопия в органической химии: научное издание. — 2-е изд., Из-во: ЛГу, Химия, Ленингр. отд-ние.- 1983. — 269 с.
- В.П.Васильев. Аналитическая химия. — «Высшая школа». — М. , 1989. - 384 с.
|
Для улучшения этой статьи
желательно
:
|
- 2021-03-01
- 1