Interested Article - Оксид хлора(VII)

- 2021-03-28
- 2
Окси́д хло́ра(VII) (дихлорогептаоксид) Cl 2 O 7 , ( хлорный ангидрид ) — кислотный оксид. Высший оксид хлора, в котором он проявляет степень окисления +7.
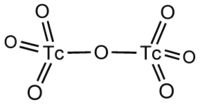
Молекула Cl 2 O 7 имеет строение О 3 Cl—О—ClO 3 (dCl—О = 0,1709 нм, в группах ClО 3 — 0,1405 нм, угол ClOCl = 118,6°, ОClO 115,2°) c пространственной симметрией C 2 , молекула полярна (μ = 2,40⋅10 −30 Кл·м).
Химические свойства
Хлорный ангидрид представляет собой бесцветную маслянистую ядовитую жидкость. Cl 2 O 7 взрывается при нагревании выше 120 °C и от удара, однако он более устойчив, чем оксид и диоксид хлора. Жидкий Cl 2 О 7 устойчив до 60—70 °C, но примесь низших оксидов хлора существенно ускоряет его распад:
-
- ΔH = 135 кДж/моль
Медленно растворяется в холодной воде, образуя хлорную кислоту :
Хлорный ангидрид является сильным окислителем, к примеру, окисляет иод до его пентаоксида :
Может вызвать самовоспламенение горючих веществ.
Получение
Получают Cl 2 О 7 при осторожном нагревании хлорной кислоты с фосфорным ангидридом или олеумом:
Оксид хлора(VII) получают также электролизом раствора НClО 4 на платиновых электродах ниже 0 °C (Cl 2 O 7 накапливается в анодном пространстве). Чистый Cl 2 O 7 можно синтезировать также при нагревании в вакууме некоторых перхлоратов , например, Nb(ClO 4 ) 5 или МоО 2 (ClO 4 ) 2 .
Нагрев сухих хлоратов металлов с жидким фторидом кислорода:
Примечания
- , с. 257.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0 .
- 2021-03-28
- 2
 ΔH = 135 кДж/моль
ΔH = 135 кДж/моль