Предел прочности
- 1 year ago
- 0
- 0

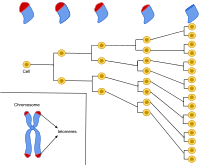
Предел или лимит Хейфлика ( англ. Hayflick limit) — граница количества делений соматических клеток , названа в честь её открывателя Леонарда Хейфлика . В 1961 году Хейфлик наблюдал, как клетки человека, делящиеся в клеточной культуре , умирают приблизительно после 50 делений и проявляют признаки старения при приближении к этой границе.
Данная граница была найдена в культурах соматических клеток как человека , так и других многоклеточных организмов . Максимальное число делений клетки различно в зависимости от её типа и ещё сильнее различается в зависимости от организма, которому эта клетка принадлежит. Для большинства человеческих клеток предел Хейфлика составляет 52 деления.
Граница Хейфлика связана с сокращением размера теломер , участков ДНК на концах хромосом . Как известно, молекула ДНК способна к репликации перед каждым делением клетки. При этом имеющиеся у неё на концах теломеры после каждого деления клетки укорачиваются. Теломеры человека в лимфоцитах периферической крови укорачиваются со скоростью примерно 70 пар нуклеотидов в год, в то время как теломеры мышей укорачиваются со скоростью 7000 пар нуклеотидов в год. При этом люди имеют относительно короткие теломеры длиной от 5 до 15 тысяч пар нуклеотидов, а у мышей длина теломер может составлять около 50 тысяч пар нуклеотидов .
В клетке существует фермент теломераза , активность которого может обеспечивать удлинение теломер, при этом удлиняется и жизнь клетки. Клетки, в которых функционирует теломераза ( половые , раковые ), бессмертны. В обычных (соматических) клетках, из которых в основном и состоит организм, теломераза «не работает», поэтому теломеры при каждом делении клетки укорачиваются, что в конечном счёте приводит к её гибели в пределах лимита Хейфлика, потому что другой фермент — ДНК-полимераза — не способен реплицировать концы молекулы ДНК.
В настоящее время предложена эпигенетическая теория старения, которая объясняет эрозию теломер прежде всего активностью клеточных рекомбиназ, активизирующихся в ответ на повреждения ДНК, вызванные, главным образом, возрастной депрессией мобильных элементов генома . Когда после определённого числа делений теломеры исчезают совсем, клетка замирает в определённой стадии клеточного цикла или запускает программу апоптоза — открытого во второй половине XX века явления планового разрушения клетки, проявляющегося в уменьшении размера клетки и минимизации количества вещества, попадающего в межклеточное пространство после её разрушения.
Принципиально, эксперимент проведённый Леонардом Хейфликом в сотрудничестве с Полом Мурхедом, был довольно простым: смешивали равные части нормальных мужских и женских фибробластов, различавшихся по количеству пройденных клеточных делений (мужские — 40 делений, женские — 10 делений) для того, чтобы фибробласты можно было отличить друг от друга в дальнейшем. Параллельно был поставлен контроль с мужскими 40-дневными фибробластами. Когда же контрольная несмешанная популяция мужских клеток перестала делиться, то смешанная опытная культура содержала только женские клетки, ведь все мужские клетки уже погибли . На основании этого Хейфлик сделал вывод, что нормальные клетки имеют ограниченную способность к делению в отличие от раковых клеток, которые бессмертны . Так было выдвинуто предположение, что так называемые «митотические часы» находятся внутри каждой клетки, на основании следующих наблюдений:
В настоящее время главенствует точка зрения, связывающая лимит Хейфлика с проявлением механизма подавления опухолеобразования, возникшего у многоклеточных организмов. Другими словами, опухолесупрессорные механизмы, такие как репликативное старение и апоптоз, бесспорно полезны в раннем онтогенезе и зрелости, но побочно являются причиной старения — ограничивают продолжительность жизни в результате накопления дисфункциональных стареющих клеток или избыточной гибели функциональных .