Interested Article - Нитрат меди(II)

- 2021-02-01
- 1
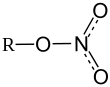
Нитра́т ме́ди(II) — неорганическое вещество с формулой , является солью двухвалентной меди и азотной кислоты . Безводный нитрат меди(II) представляет собой бесцветные гигроскопичные кристаллы. При поглощении влаги образует кристаллогидраты голубого цвета.
Нахождение в природе
Нитрат меди(II) (в форме осно́вной соли ) встречается в природе в виде минералов и . Свойства минералов представлены в таблице:
| Состав | Cu 2 NO 3 (OH) 3 | Cu 2 NO 3 (OH) 3 |
|---|---|---|
| Цвет | зелёный | темно-зелёный |
| Сингония | орторомбическая | моноклинная |
| Плотность, г/см³ | 3,40—3,43 | 3,38 |
| Твердость | 2 | 2 |
Физические свойства
Безводный нитрат меди(II) при нормальных условиях — твёрдое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H 2 O при 20 °C; 207,7 г/100 г H 2 O при 80 °C), этаноле , метаноле , этилацетате , ацетонитриле , ДМСО .
При кристаллизации из водных растворов образует ряд кристаллогидратов : нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H 2 O. Параметры кристаллической решетки кристаллогидратов :
- Cu(NO 3 ) 2 ·6H 2 O: триклинная сингония , пространственная группа P 1, параметры ячейки a = 0,591 нм , b = 0,777 нм , c = 0,543 нм , α = 97,65° , β = 93,88° , γ = 72,53° , Z = 1 .
- Cu(NO 3 ) 2 ·3H 2 O: ромбическая сингония , пространственная группа Pmn 2 1 , параметры ячейки a = 1,12 нм , b = 0,505 нм , c = 0,528 нм , Z = 4 .
- Cu(NO 3 ) 2 ·2,5H 2 O: моноклинная сингония , пространственная группа I 2/ a , параметры ячейки a = 1,64539 нм , b = 0,49384 нм , c = 1,59632 нм , β = 93,764° , Z = 8 .
- Cu(NO 3 ) 2 ·1,5H 2 O: моноклинная сингония , пространственная группа C 2/ c , параметры ячейки a = 2,22 нм , b = 0,490 нм , c = 1,54 нм , β = 48° , Z = 8 .
Гексагидрат разлагается при нагревании до 100 °C в вакууме . Тригидрат разлагается при 120 °C .
Химические свойства
Разложение
Нитрат меди(II) при нагревании разлагается с образованием оксида меди(II) и диоксида азота :
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты . Реакция протекает в горячей воде:
Гидролиз
Нитрат меди(II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона :
Катион тетрааквамеди(II) подвергается обратимому гидролизу :
В упрощённом виде:
Обменные реакции
В водных растворах нитрат меди(II) вступает в
реакции ионного обмена
, характерные для растворимых
солей
двухвалентной
меди
, например:
с
щёлочью
(выпадает голубой осадок)
с фосфатом натрия (выпадает синий осадок)
с жёлтой кровяной солью (выпадает красный осадок)
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
с азидами щелочных металлов (выпадает коричневый осадок азида меди(II) )
Прочие реакции
Нитрат меди(II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди(I) :
Нитрат меди(II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка ( аддукта ):
Получение
Нитрат меди(II) может быть получен растворением в азотной кислоте металлической меди , оксида меди(II) или гидроксида меди(II) :
Безводный нитрат меди(II) может быть получен при взаимодействии меди с тетраоксидом диазота . Реакция протекает при 80 °C в этилацетате ):
Применение
Нитрат меди(II) используют для получения чистого оксида меди(II) , медьсодержащих катализаторов , как фунгицид , протраву при крашении тканей .
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений (т. н. «условия Менке») .
Токсичность
Нитрат меди(II) является умеренно-токсичным веществом — LD 50 для крыс перорально 950 мг/кг (тригидрат).
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы .
Представляет опасность для окружающей среды — LC 50 для рыб 0,29 мг/л в течение 96 ч.
Примечания
- При быстром нагревании или избыточном давлении.
- . Дата обращения: 28 июля 2010. 2 мая 2012 года.
- . Дата обращения: 28 июля 2010. 2 мая 2012 года.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М. : Дрофа, 2007. — С. . — 637 с. — ISBN 978-5-358-01303-2 .
- ↑ [www.xumuk.ru/encyklopedia/2460.html Нитрат меди на xumuk.ru] . Дата обращения: 15 июля 2010.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М. : Дрофа, 2006. — С. 104. — 685 с. — ISBN 5-7107-8085-5 .
- Menke J. B. Nitration with nitrates (неопр.) // Recueil des Travaux Chimiques des Payes-Bas. — 1925. — Т. 44 . — С. 141 .
- 2021-02-01
- 1



![{\displaystyle {\mathsf {Cu(NO_{3})_{2}+4\ H_{2}O\longrightarrow \ [Cu(H_{2}O)_{4}]^{2+}+2\ NO_{3}^{-}}}}](/images/005/460/5460314/13.jpg?rand=136836)
![{\displaystyle {\mathsf {[Cu(H_{2}O)_{4}]^{2+}+\ H_{2}O\rightleftarrows \ [Cu(H_{2}O)_{3}(OH)]^{+}+\ H_{3}O^{+}}},\ pK_{a}\ =7,34}](/images/005/460/5460314/14.jpg?rand=638659)



![{\displaystyle {\mathsf {2Cu(NO_{3})_{2}+\ K_{4}[Fe(CN)_{6}]\longrightarrow \ Cu_{2}[Fe(CN)_{6}]\!\downarrow +4\ KNO_{3}}}}](/images/005/460/5460314/18.jpg?rand=952599)
_{2}+4\ H_{2}O}}}](/images/005/460/5460314/19.jpg?rand=559909)