Interested Article - Карбанион
- 2021-02-01
- 1
При присоединении лишнего электрона к атому углерода (это происходит, когда при отщеплении какого-либо атома или группы атомов оба общих электрона, образующих связь, остаются при углеродном атоме) образуется отрицательно заряженный атом - карбанион .
R : Y -> R - ' : + Y +
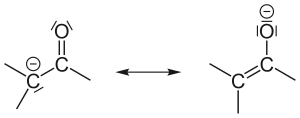
Карбанион — анион , содержащий чётное число электронов со свободной электронной парой на четырехвалентном атоме углерода. К карбанионам относят как анионы с локализованным на углеродном атоме отрицательным зарядом, так и анионы с делокализованным отрицательным зарядом, у которых по крайней мере в одной из канонических структур заряд локализован на атоме углерода :
Свойства
Карбанионы являются сопряженными основаниями для углеводородов, выступающих в роли кислот Льюиса.
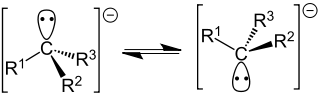
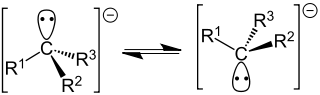
Карбанионные центры могут находиться в состоянии sp 3 -гибридизации (например, Cl 3 C - ), промежуточном состоянии между sp 3 и sp 2 -гибридизациями (например, в енолят-анионах ) и sp 1 -гибридизации (в ацетиленидах R-С≡C - ).
Способы получения
- Ионизация под действием растворителя для металл-органических соединений.
- Действие сильных оснований на достаточно кислую (поляризованную) связь C-H.
- Присоединение анионов по кратным связям.
Факторы стабилизации
- Пространственный фактор — экранирование реакционного центра.
- Резонансный фактор — чем больше резонансных структур имеет карбанион, тем более он стабилен.
- Природа и положение заместителей в углеродной цепи — акцепторные заместители стабилизируют карбанион.
Химические свойства
- Взаимодействие с электрофилами.
- Окисление до радикалов .
Примечания
- Степаненко Б.Н. Курс органической химии. — 600 с.
- . Дата обращения: 1 августа 2012. 14 октября 2012 года.
Литература
- Кнунянц И. Л. и др. т.2 Даффа-Меди // Химическая энциклопедия. — М. : Советская энциклопедия, 1990. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5 .
- 2021-02-01
- 1