Interested Article - Индол

- 2020-05-16
- 1
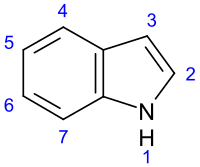
Индо́л ( бензопирро́л , 2,3-бензпиррол ) — гетероциклическое конденсированное ароматическое соединение .
Бесцветные кристаллы с запахом, напоминающим запах капусты .
Индольное ядро входит во множество биохимических природных соединений. Как индивидуальное вещество содержится в каменноугольной смоле и в некоторых эфирных маслах , например, в масле жасмина .
История

Изучение индола началось с изучения растительного красителя индиго . Из индиго окислением можно получить изатин , а затем в индоксил . В 1866 году Адольф фон Байер восстановил цинковой пылью индоксил до индола . В 1869 году он предложил химическую структурную формулу для индола (на рисунке слева) .
Некоторые производные индола очень широко использовались в качестве красителей до конца 19-го века. В 1930-х годах интерес к индолу вновь увеличился, когда стало известно, что индольное ядро входит в молекулы многих важных алкалоидов , в аминокислоту триптофан , в ауксины и другие биохимически важные вещества. Но и в наши дни он продолжает интенсивно изучаться .
От слова «индиго» индол и получил своё название.
Физические свойства
При нормальных условиях представляет собой бесцветные листовидные кристаллы с резким запахом, напоминающим запах прелой капустной кочерыжки. Легко краснеет при воздействии солнечного света и воздуха . В сильно разбавленном виде запах цветочный и напоминает цветки жасмина .
Растворимость в некоторых растворителях
- в бензоле — растворим;
- в воде — 0,36 г/100 г (при 25 °C) — плохо растворим;
- в диэтиловом эфире — легко растворим;
- в лигроине — растворим;
- в метаноле — растворим;
- в этаноле — 35,9 г/100 г (при 20 °C).
Химические свойства
Индол по своей реакционной способности схож с бензолом , но более реакционноспособен. Неподеленная пара электронов азота в индоле является частью ароматического секстета, поэтому индол не проявляет склонности к связыванию протона и лишен основных свойств. Напротив, в реакциях с сильными основаниями индол проявляет свойства слабой NH-кислоты.
Как слабая кислота, индол в растворе натрия в жидком аммиаке (NH 3 ) образует N-натрийиндол, с гидроксидом калия (КОН) при 130 °C — N-калийиндол.
Обладает ароматическими свойствами. Электрофильное замещение идёт главным образом в положении атома углерода 3.
Нитрование обычно осуществляется , сульфирование — , — , хлорирование — SO 2 Cl 2 , алкилирование — активными алкилгалогенидами.
Ацетилирование в уксусной кислоте также идёт в положение 3, в присутствии ацетата натрия (CH 3 COONa) — в положение 1.
В уксусном ангидриде образуется . Индол легко присоединяется по двойной связи a, b к непредельным кетонам и нитрилам .
( реакция Манниха ) в мягких условиях протекает в положение 1, в жёстких — в положение 3.
Замещение в бензольном кольце (преимущественно в положения 4 и 6) идёт лишь в кислых средах при блокированном присоединения по атому в положении 3. В присутствии воды, надкислот или на свету индол окисляется в индоксил , который затем превращается в димер, называемый индиго .
Более жёсткое окисление под действием озона (О 3 ), диоксида марганца MnO 2 приводит к разрыву пиррольного кольца с образованием . При гидрировании индола водородом в мягких условиях восстанавливается пиррольное кольцо, в более жёстких — и бензольное.
Нахождение в природе
Индол и его гомолог скатол образуются в кишечнике человека и других млекопитающих в результате расщепления гнилостными бактериями аминокислоты триптофана — скатол обладает очень неприятным запахом, но в крайне малых концентрациях он имеет запах жасмина (в эфирном масле которого содержится) и применяется в парфюмерии.
Индол содержится в эфирных маслах жасмина и цитрусовых, входит в состав каменноугольной смолы .
Индольное ядро — фрагмент молекул многих важных природных биохимических соединений (например, триптофана, серотонина , мелатонина , буфотенина ).
Ядро индола является R-группой одной из 20 кодируемых аминокислот — триптофана, и поэтому присутствует практически в любом белке . Ядро индола также входит в состав индольных алкалоидов .
Получение
Обычно индол выделяют из нафталиновой фракции каменноугольной смолы или получают дегидрированием о -этиланилина с последующей циклизацией образующегося продукта.
Синтез
Индол и его производные синтезируют циклизацией карбонильных соединений ( реакция Фишера ), взаимодействием с α-галоген- или α-гидроксикарбонильными соединениями ( ).
Применение
Индол служит исходным сырьём для синтеза гетероауксина , триптофана , используется в парфюмерной и фармацевтической промышленности. В парфюмерии индол применяют как фиксатор запаха .
Индол и его производные используют при синтезе многих биологически активных соединений ( гормонов , галлюциногенов ) и лекарственных средств (например, индопана , индометацина , индол-3-карбинола ).
Примечания
- (англ.) / — 97 — Boca Raton: 2016. — P. 6—112. — ISBN 978-1-4987-5428-6
- (нем.) // : magazin. — 1866. — Bd. 140 , Nr. 3 . — S. 295—296 . — doi : .
- ; Emmerling, A. (нем.) // : magazin. — 1869. — Bd. 2 . — S. 679—682 . — doi : . 17 мая 2020 года.
- Van Order, R. B.; Lindwall, H. G. Indole (англ.) // : journal. — 1942. — Vol. 30 . — P. 69—96 . — doi : .
- . Дата обращения: 22 июня 2023. 22 июня 2023 года.
- . Дата обращения: 22 июня 2023. 22 июня 2023 года.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М. : Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8 .
- 2020-05-16
- 1