Interested Article - Дифосфин

- 2020-09-14
- 1
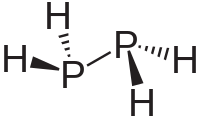
Дифосфин — неорганическое соединение фосфора с водородом состава P 2 H 4 , содержащее связь фосфор-фосфор. Гомологичен гидразину , очень токсичен и склонен к самовозгоранию (примесью дифосфина объясняется самовозгорание фосфина в воздухе, тогда как чистый фосфин таким свойством не обладает).
Название
В англоязычной литературе часто используют название по аналогии с органическими предельными углеводородами с окончанием -ан: diphosphane ( дифосфан ), при этом дифосфинами называют фосфорорганические соединения, наиболее часто используемые в качестве бидентатных фосфиновых лигандов в неорганической и металлоорганической химии. Но такое различие не устоявшееся и ряд других источников придерживаются названия дифосфин .
Получение
Дифосфин получают путем гидролиза монофосфида кальция, которого более правильно записывать как производное P 2 4− , аналогичному пероксиду водорода. По оптимизированной методике гидролиз 400 г Са 2 Р 2 при −30 °С дает около 20 г продукта, слегка загрязненного фосфином :
Строение, свойства
По строению близок к гидразину, менее симметричный, с расстоянием связи P-P в 2,219 ангстрем.
Дифосфин — при температуре выше −99 °C представляет собой бесцветную жидкость, разлагается в присутствии следов кислоты, при температуре выше −10 °С (особенно под действием света) и на шероховатых поверхностях. Он смешивается с сероуглеродом , пиридином , углеводородами , простыми эфирами , монометиловым эфиром диэтиленгликоля, диметиловым эфиром диэтиленгликоля, триамидом гексаметилфосфорной кислоты и растворим в метаноле . В воде нерастворим.
Дифосфин самовоспламеняется на воздухе:
При температуре выше −30 °C он медленно диспропорционирует до PH 3 и высших фосфинов . Он часто встречается в виде примеси в коммерчески доступном монофосфине.
Реакция дифосфина с бутиллитием дает множество конденсированных полифосфиновых соединений .
Органические дифосфины
Известно множество органических производных дифосфина. Эти виды получают редуктивным связыванием тетрафенилдифосфина из хлордифенилфосфина:
2ClPPh 2 + 2Na → Ph 2 P−PPh 2 + 2NaCl
Метиловое соединение P 2 (CH 3 ) 4 получают восстановлением (CH 3 ) 2 P(S)−P(S)(CH 3 ) 2 , которое получают метилированием тиофосфорилхлорида метилмагнийбромидом .
Примечания
- Marianne. Baudler, Klaus. Glinka. (англ.) // Chemical Reviews. — 1993-06-01. — Vol. 93 , iss. 4 . — P. 1623–1667 . — ISSN . — doi : . 19 марта 2023 года.
- hrsg. von Georg Brauer. Unter Mitarb. von M. Baudler. . — 3., umgearb. Aufl. — Stuttgart: Enke, 1975. — С. 516. — XI, 608 Seiten с. — ISBN 3-432-02328-6 , 978-3-432-02328-1.
- Arnold F. Holleman. . — 101., verb. und stark erw. Aufl. — Berlin, 1995. — С. 745. — XXXIX, 2033 S с. — ISBN 978-3-11-012641-9 , 3-11-012641-9.
- Peter Petzold. . — Berlin: Walter de Gruyter, 2009. — С. 658. — 1 online resource (xv, 953 pages) с. — ISBN 978-3-11-021135-1 , 3-11-021135-1.
- S. A. Butter, J. Chatt, E. R. Wonchoba, G. W. Parshall. // Inorganic Syntheses / George W. Parshall. — Hoboken, NJ, USA: John Wiley & Sons, Inc., 2007-01-05. — С. 185–191 . — ISBN 978-0-470-13246-3 , 978-0-470-13176-3 . — doi : . 19 марта 2023 года.
Литература
- Некрасов Б. В. Основы общей химии. — Т.1. — М.: Химия, 1973
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977
- 2020-09-14
- 1