Краун-эфиры
- 1 year ago
- 0
- 0


Просты́е эфи́ры — органические вещества , имеющие формулу R-O-R', где R и R' — алкильные, арильные или другие заместители. Простые эфиры являются летучими жидкостями с приятным запахом. Благодаря своей химической инертности и особым сольватационным свойствам они широко используются как растворители в промышленности и лаборатории.
Рекомендации ИЮПАК позволяют при присвоении названий простым эфирам вида R-O-R' использовать разные типы номенклатуры:
Заместительная номенклатура является предпочтительной. В этом случае один из радикалов (R) выполняет роль родоначального углеводорода (RH) и получает название, соответствующее этому углеводороду. Группа R’O- считается заместителем, и её название образуется слиянием названия радикала R' и приставки окси , например:
В нескольких случаях за заместителем R’O- сохранено традиционное название:
В таком случае полные названия простых эфиров выглядят следующим образом:
В радикало-функциональной номенклатуре названия заместителей перед словом «эфир» перечисляются в алфавитном порядке:
Заменительную номенклатуру удобно использовать в случае полиэфиров. В этом случае соединение называется как углеводород, а место, где углеродный атом формально заменён кислородом, называют в виде приставки «окса»-:
В редких случаях, когда оба заместителя в простом эфире являются циклическими, можно использовать умножительную номенклатуру :

Эфиры — бесцветные, подвижные, легкокипящие жидкости с характерным запахом. Эфиры малорастворимы в воде, но хорошо растворяются в органических растворителях и сами растворяют органические соединения .

Строение молекул простых эфиров схоже со строением молекулы воды . Валентный угол С–O–C в диметиловом эфире составляет 112°. Атом кислорода имеет sp 3 - гибридизацию .
Характеристической полосой простых эфиров в инфракрасном спектре является полоса при 1150–1080 см –1 , соответствующая колебаниям группы C–O–C .
В спектрах 1 Н ЯМР группа CH 3 O алкиловых эфиров имеет сигнал при 3,3-4,0 м. д. , а та же группа метилариловых эфиров — при 3,7 м. д. Сигналы протонов двойной связи в виниловых эфирах (вида СН=СН–О) находятся при 5,7-7,5 м. д. (α-положение) и 3,5-5,0 м. д. (β-положение). Если сравнивать эти значения с положением сигналов в аналогичной углеводородной системе СН=СН–С, то сигнал α-углеродного атома оказывается смещённым на +1,2 м. д., а сигнал β-углеродного атома — на –1 м. д.
В спектрах 13 C ЯМР насыщенных простых эфиров атом углерода, находящийся в α-положении от атома кислорода, даёт сигнал в области 50-100 м. д., а более удалённые атомы углерода — в области 10-60 м. д. У виниловых эфиров углероды двойной связи (С=С–О) дают сигналы при 115-165 м. д. (α-положение) и 70-120 м. д. (β-положение). При этом, если сравнивать спектры с углеводородными системами типа С=С–С, то сигнал α-углеродного атома в виниловых эфирах оказывается смещённым на +15 м. д., а сигнал β-углеродного атома — на –30 м. д. У ароматических простых эфиров сигнал α-углеродного атома кольца наблюдается при 135-155 м. д. (смещение +25 м. д. по сравнению с ареном). Сигналы остальных ароматических атомов углерода при введении эфирной группы смещаются на –15 м. д. ( орто -положение), +1 м. д. ( мета -положение) и –8 м. д. ( пара -положение) .
В масс-спектрах алифатических простых эфиров молекулярный ион проявляется в виде слабого сигнала, для ароматических простых эфиров — в виде интенсивного сигнала. Основное направление фрагментации молекулярного иона — разрыв связи между α- и β-углеродными атомами и гетеролитический разрыв связи C–O. В результате возникают ионы с массой (m/z), равной 31, 45, 59... М–46, М–33, М–18 .
Для алкилариловых простых эфиров фрагментация протекает через потерю алкильной цепи. У диариловых эфиров молекулярный ион или ион М–Н теряет группу CO, а также происходит разрыв связи между атомом кислорода и арильным заместителем. Также в ходе масс-спектрометрии простые эфиры претерпевают перегруппировки с отщеплением молекулы спирта либо — в случае ариловых простых эфиров — с отщеплением алкена и образованием фенола .
При нагревании первичных
спиртов
с концентрированной
серной кислотой
при 130—140 °С образуются простые эфиры. С точки зрения
механизма реакции
, происходит алкилирование спирта под действием катиона алкоксония ROH +
2 или полуэфира серной кислоты ROSO
3
H
.
Этот метод пригоден для получения некоторых простейших эфиров: диэтилового , , дибутилового эфиров , тетрагидрофурана и диоксана . Недостатком этого метода является то, что вторичные и третичные спирты в этих условиях дегидратируются , превращаясь в алкены . Также он не позволяет получать несимметричные простые эфиры из двух разных спиртов, поскольку при этом получается смесь трёх продуктов .
Промышленным вариантом этой реакции является дегидратация спиртов в газовой фазе над оксидом алюминия , бокситом и другими катализаторами при нагревании до 180—250 °С. Выход эфиров в таких процессах составляет до 75 % .
Спирты присоединяются к алкенам в присутствии кислотных катализаторов (серной, фосфорной кислоты , хлороводорода , фторида бора и др.), образуя простые эфиры .
В промышленности таким способом получают простые эфиры из изобутилена либо и метанола либо этанола , нагревая их над катионитом в кислой форме. При этом получают трет -бутилметиловый , трет -бутилэтиловый , трет -амилметиловый и .
В лабораторных условиях большее значение имеет реакция алкоксимеркурирования алкенов. Она аналогична реакции оксимеркурирования, при помощи которой алкены селективно превращают в спирты, однако в данном случае роль нуклеофильного реагента выполняет не вода, а спирт, который берут в качестве растворителя. Сам алкен вводят в реакцию с ацетатом ртути либо — для получения эфиров со вторичной или третичной алкильной группой — , а затем полученный продукт демеркурируют при помощи . Формально эта реакция представляет собой присоединения спирта по двойной связи согласно правилу Марковникова .
Симметричные и несимметричные простые эфиры можно получить по реакции Вильямсона между алкоголятами и галогеналканами (либо сульфонатами ). Эта реакция представляет собой нуклеофильное замещение по механизму S N 2, и для неё верны соответствующие закономерности. Например, если в конечном продукте содержится вторичный или третичный заместитель, его следует вводить при помощи алкоголята, а не галогенида, поскольку в ином случае вместо замещения будет происходить реакция элиминирования . Наилучшими галогенидами в этой реакции являются первичные галогениды, а также аллил- и бензилгалогениды .
Симметричные простые эфиры можно получить из двух молекул галогеналкана в присутствии оксида серебра(I) . Так, например, поступают в случае ди- трет -бутилового эфира, который трудно получить другими способами: трет -бутилхлорид вводят в реакцию с карбонатом серебра .
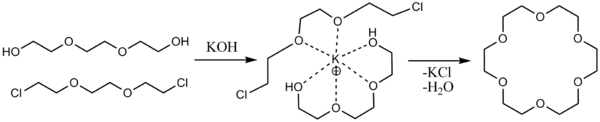
Интерес к реакции Вильямсона связан также с получением краун-эфиров . В этих процессах катион металла в алкоголяте выполняет роль матрицы при сборке макроцикла. Радиус ионов лития, натрия и калия соответствует размеру полости в , и 18-краун-6 , и наличие этих катионов сильно повышает выход соответствующих краун-эфиров .
Метиловые простые эфиры получают по реакции спиртов с диазометаном в присутствии кислот Льюиса (фторида бора, хлорида алюминия и др.) .
Простые эфиры являются химически инертными веществами. Они устойчивы ко многим реагентам основной природы: не реагируют с гидридами , амидами щелочных металлов, комплексными гидридами, щелочными металлами . Также простые эфиры не гидролизуются щелочами .
Химическая инертность простых эфиров позволяет применять их в качестве растворителей. В частности, они используются в реакциях восстановления алюмогидридом лития и . Их сольватирующая способность объясняется тем, что они являются жёсткими основаниями Льюиса и образуют устойчивые комплексы с реактивами Гриньяра , , а также другими типичными кислотами Льюиса .
Также простые эфиры образуют комплексы с галогенами. Например, раствор иода в диэтиловом эфире имеет коричневую окраску, а не фиолетовую, как в алканах, что объясняется образованием комплекса и изменением спектра поглощения . С очень сильными алкилирующими реагентами простые эфиры образуют соли триалкилоксония .
Концентрированные бромоводородная и иодоводородная кислоты (48 %) при нагревании до 120—150 °С расщепляют простые эфиры с образованием спирта и галогеналкана. Легче всего расщепляются простые эфиры, имеющие третичную алкильную группу. Эту реакцию в 1861 году открыл А. М. Бутлеров .
Механизм кислотного расщепления основан на реакции S N 1 или S N 2, которая протекает в эфире, протонированном по атому кислорода. Если эфир содержит первичные или вторичные заместители, галогенид-ион атакует его протонированную форму по менее замещённому атому углерода. При одновременном присутствии первичной и вторичной алкильной группы галогенид селективно атакует первичную группу, в результате чего образуются первичный галогенид и вторичный спирт .
Простые эфиры с третичными заместителями реагируют по механизму S N 1 в более мягких условиях. Их можно расщеплять трифторуксусной кислотой . Аналогичное действие на простые эфиры оказывают хлорид бора и бромид бора , но в их случае расщепление происходит уже при −20 °С, что может быть полезно в том случае, когда в жёстких условиях протекают побочные реакции .
Метил- и этилалкиловые эфиры расщепляют иодоводородной кислотой, чтобы количественно определить наличие метокси- и этоксигрупп по методу Цейзеля . Выделившиеся при такой обработке метилиодид и этилиодид пропускают через раствор нитрата серебра и определяют их количество по массе выпавшего иодида серебра либо окислением (по количеству образовавшегося иода) .
По аналогии с алканами, простые эфиры вступают в реакции радикального галогенирования , однако в случае эфиров эта реакция протекает региоселективно по положению, соседнему с атомом кислорода (по α-положению). Эта селективность связана с тем, что галогенирование протекает через образование особо устойчивого радикала, где 2p-орбиталь с неспаренным электроном перекрывается с 2p-орбиталью, на которой находится неподелённая электронная пара атома кислорода .
При доступе воздуха, особенно на свету, простые эфиры окисляются по радикальному механизму и образуют неустойчивые гидропероксиды и пероксиды , которые могут разлагаться со взрывом. Это известно из многочисленных случаев взрывов при перегонке эфиров, которые происходили из-за накопления в кубе менее летучих пероксидов и их резкого разложения при попытке отогнать растворитель досуха. Катализировать этот процесс могут любые источники радикалов .
трет -Бутилметиловый и трет -амилметиловый эфиры более устойчивы к радикальному окислению и образуют меньше пероксидов. Предотвратить этот процесс можно при помощи ловушек радикалов, например фенолов и аминов . Часто в диэтиловый эфир добавляют ионол (1-30 мг/кг) либо другие стабилизаторы .
Простые эфиры используются как растворители для жиров, смол, красителей и лаков. Также они используются в качестве растворителей в органических реакциях. Некоторые эфиры применяют как анестетики , топливные присадки для повышения октанового числа и смазочные масла . Некоторые простые эфиры являются инсектицидами и фумигантами , поскольку их пары токсичны для насекомых .
Ариловые простые эфиры находят применение в качестве антиоксидантов и консервантов . Некоторые ароматические простые эфиры имеют приятный запах, благодаря чему их используют в парфюмерной промышленности .