Interested Article - Фруктозо-2,6-бисфосфат

- 2020-06-11
- 1
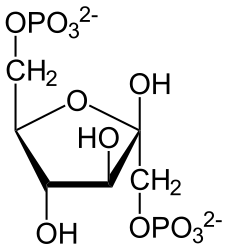
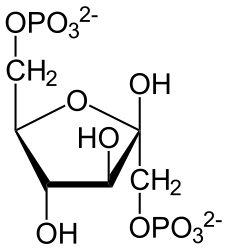
Фруктозо-2,6-бисфосфат ( фруктозо-2,6-дифосфат , Фр-2,6-Ф , Fru-2,6- P 2 ) — регуляторная молекула всех эукариот , аллостерически , влияющая на активность ферментов фосфофруктокиназы 1 (ФФК-1) и фруктозо-1,6-бисфосфатазы (ФБФаза-1). Усиливает гликолиз и подавляет глюконеогенез . Представляет собой эфир фосфорной кислоты и фруктозы .
У растений и животных синтез и распад Фр-2,6-Ф осуществляется фосфофруктокиназой-2 /фруктозо-2,6-бисфосфатазой (ФФК-2/ФБФ-2) — бифункциональным ферментом с двумя активными центрами . Фр-2,6-Ф образуется путём фосфорилирования фруктозо-6-фосфата с использованием одной молекулы АТФ , а в результате деградации распадается на фруктозо-6-фосфат и Ф н .
История открытия
Фруктозо-2,6-бисфосфат был открыт через 71 год после того, как Янг в лаборатории Гардена выделил из дрожжей первый двойной эфир фруктозы и фосфорной кислоты, который позже был идентифицирован как фруктозо-1,6-бисфосфат . В 1979 году четыре группы исследователей сообщили, что в гепатоцитах , инкубированных в присутствии гормона глюкагона , происходит снижение активности фермента фосфофруктокиназы-1 . В 1980 году Эмили Ван Шафтинген и коллеги показали, что этот эффект исчезает после проведения гель фильтрации или очистки фермента. Далее, они показали, что можно добиться усиления активности фосфофруктокиназы-1 просто добавив к гепатоцитам низкомолекулярную фракцию, полученную после ультрацентрифугирования экстракта печени . Выделенный из этой фракции низкомолекулярный стимулятор был идентифицирован исследователями как фруктозо-2,6-бисфосфат .
Влияние на метаболизм глюкозы у животных
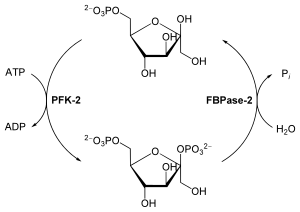
Фруктозо-2,6-бисфосфат стимулирует распад глюкозы , аллостерически активируя фосфофруктокиназу 1. Например, в печени высокая концентрация Фр-2,6-Ф активирует ФФК-1, увеличивая её сродство к фруктозо-6-фосфату и снижая сродство к её прямым ингибиторам: АТФ и цитрату . В своей физиологической концентрации ФФК-1 практически полностью не активна, но взаимодействие с Фр-2,6-Ф переводит фермент в активную форму и стимулирует гликолиз . Помимо этого фруктозо-2,6-бисфосфат ингибирует фруктозо-1,6-бисфосфатазу, что предотвращает распад образовавшегося фруктозо-1,6-бисфосфата. Таким образом Фр-2,6-Ф не даёт одновременно идти процессам гликолиза и глюконеогенеза, что могло бы привести к бесполезному циклу, в котором глюкоза бесконечно превращалась бы в пируват , а затем обратно в глюкозу .
Уровень Фр-2,6-Ф в клетке контролируется через регуляцию его синтеза и распада ферментом ФФК-2/ФБФазой-2. Основную роль в этом процессе играют гормоны инсулин , глюкагон и адреналин , которые воздействуют на фермент через фосфорилирование /дефосфорилирование. Так, глюкагон активирует аденилатциклазу печени и запускает синтез цАМФ , который, в свою очередь, активирует цАМФ-зависимую протеинкиназу. Эта киназа фосфорилирует ФФК-2/ФБФазу-2 по N-концевому остатку серина , что стимулирует фруктозо-2,6-бисфосфатазную активность и подавляет его работу как фосфофруктокиназы-2. Происходит снижение уровня Фр-2,6-Ф в клетке. В условиях низкого уровня Фр-2,6-Ф гликолиз подавляется, в то время как глюконеогенез, напротив, усиливается. Инсулин запускает обратный процесс. При повышении его концентрации происходит снижение уровня цАМФ, что в свою очередь активирует протеинфосфатазу , которая дефосфорилирует ФФК-2/ФБФазу-2, активируя фосфофруктокиназную-2 и подавляя фруктозо-2,6-бисфосфатазную активность. Таким образом, повышение уровня Фр-2,6-Ф активирует фермент ФФК-1 и стимулирует гликолиз, подавляя глюконеогенез .
Влияние на метаболизм глюкозы у грибов
В целом, действие фруктозо-2,6-бисфосфата у грибов аналогично таковому у животных: повышение его концентрации стимулирует гликолиз и подавляет глюконеогенез . У части грибов фермент, ответственный за синтез Фр-2,6-Ф, не чувствителен к уровню цАМФ и АТФ . Вместо этого регуляция ФФК-2/ФБФ-2 осуществляется по уровню основного субстрата — фруктозо-6-фосфата и общего количества источника углерода . У другой части грибов, в том числе и у дрожжей , напротив, есть цАМФ-зависимый путь регуляции ФФК-2/ФБФ-2, а его фосфофруктокиназная активность подавляется высокими уровнями АТФ . В целом, нельзя выделить какой-то общий для всех грибов механизм регуляции уровня Фр-2,6-Ф. Скорее всего, он сильно зависит от его образа жизни и занимаемой грибом экологической ниши.
Регуляция синтеза сахарозы у растений
У растений , в отличие от животных , фруктозо-2,6-фосфат не действует на АТФ-зависимую фосфофруктокиназу 1, но чётко стимулирует пирофосфат -зависимую фосфофруктокиназу, которая фосфорилирует фруктозо-6-фосфат, используя неорганический пирофосфат , и ингибирует фосфатазу . Фр-2,6-Ф играет важную роль в регуляции уровня триозофосфатов, конечного продукта цикла Кальвина . Он ингибирует образование фруктозо-6-фосфата, основного субстрата для синтеза сахарозы . При интенсивном фотосинтезе происходит постоянное образование триозофосфатов ( глицеральдегид-3-фосфата и 3-фосфоглицерата ), которые аллостерически взаимодействуют с ФФК-2/ФБФазой-2 и ингибируют синтез фруктозо-2,6-бисфосфата, стимулируя таким образом образование сахарозы. Фр-2,6-Ф начинает синтезироваться в темноте, когда не идут процессы фотосинтеза и образования триозофосфатов. У растений этот процесс аллостерически активизируется неорганическим фосфатом и фруктозо-6-фосфатом . Таким образом, синтез регуляторной молекулы сложным образом зависит от соотношения С 6 /С 3 сахаров в растительной клетке . На это соотношение будет активно влиять интенсивность синтеза сахарозы и транспорт в хлоропласты Ф н в обмен на триозофосфат .
Примечания
- Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М. : Издательская группа «ГЭОТАР-Медиа», 2011. — С. 95. — 624 с.
- ↑ Lange AJ. (неопр.) . University of Minnesota. 13 июня 2015 года.
- Wu C., Khan S. A., Peng L. J., Lange A. J. Roles for fructose-2,6-bisphosphate in the control of fuel metabolism: beyond its allosteric effects on glycolytic and gluconeogenic enzymes (англ.) // Adv. Enzyme Regul. : journal. — 2006. — Vol. 46 , no. 1 . — P. 72—88 . — doi : . — .
- ↑ Kurland I. J., Pilkis S. J. Covalent control of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: insights into autoregulation of a bifunctional enzyme (англ.) // (англ.) (: journal. — 1995. — June (vol. 4 , no. 6). — P. 1023—1037 . — doi : . — . — PMC .
- Michels P. A. , Rigden D. J. (англ.) // IUBMB life. — 2006. — Vol. 58, no. 3 . — P. 133—141. — doi : . — . [ ]
- (неопр.) . Дата обращения: 28 июня 2015. 1 июля 2015 года.
- E. Van Schaftingen, L. Hue, and H. G. Hers. (англ.) // (англ.) (: journal. — 1980. — 15 December (vol. 192 , no. 3). — P. 897—901 .
- H. G. Hers and E. Van Schaftingen. (англ.) // (англ.) (: journal. — 1982. — 15 July (vol. 206 , no. 1). — P. 1—12 .
- Smith W. E., Langer S., Wu C., Baltrusch S., Okar D. A. Molecular coordination of hepatic glucose metabolism by the 6-phosphofructo-2-kinase/fructose-2,6- bisphosphatase:glucokinase complex (англ.) // (англ.) (: journal. — 2007. — June (vol. 21 , no. 6). — P. 1478—1487 . — doi : . — .
- , с. 144—146.
- José Abrahão Neto. Characterization of phosphofructokinase II and regulation of fructose 2,6-bisphosphate levels in Trichoderma reesei (англ.) // Microbiology : journal. — 1993. — June (vol. 139). — P. 1363—1369 . — doi : .
- Vandercammen A1, François J. M., Torres B. B., Maia J. C., Hers H. G. Fructose 2,6-bisphosphate and carbohydrate metabolism during the life cycle of the aquatic fungus Blastocladiella emersonii. (англ.) // (англ.) (: journal. — (англ.) (, 1990. — January (vol. 136 , no. 1). — P. 137—146 . — .
- Gandhi Radis-BaptistaDavid N., Urquizo Valdivia, José Abrahão-Neto. Fructose 2,6-bisphosphate biosynthesis and regulation of carbohydrate metabolism in Aspergillus oryzae (англ.) // (англ.) (: journal. — (англ.) (, 2011. — January (vol. 44 , no. 1). — P. 6—11 . — doi : .
- Dihazi H1, Kessler R., Eschrich K. Glucose-induced stimulation of the Ras-cAMP pathway in yeast leads to multiple phosphorylations and activation of 6-phosphofructo-2-kinase. (англ.) // Biochemistry : journal. — 2003. — 27 May (vol. 42 , no. 20). — P. 6275—6282 . — doi : . — .
- ↑ , с. 223.
- Nielsen T. H., Rung J. H., Villadsen D. Fructose-2,6-bisphosphate: a traffic signal in plant metabolism (англ.) // (англ.) (: journal. — 2004. — November (vol. 9 , no. 11). — P. 556—563 . — doi : . — .
Литература
- Д. Нельсон, М. Кокс. Основы биохимии Ленинджера: в 3 т. — М. : БИНОМ, 2014. — Т. 2. — С. 144—146. — 636 с. — ISBN 978-5-94774-366-1 .
- Физиология растений / Под ред. И. П. Ермакова. — М. : Академия, 2005. — 634 с.
- 2020-06-11
- 1