Interested Article - Транспозоны

- 2020-05-15
- 1
Транспозоны ( англ. transposable element, transposon) — участки ДНК организмов, способные к передвижению (транспозиции) и размножению в пределах генома . Транспозоны также известны под названием «прыгающие гены» и являются примерами мобильных генетических элементов .
Транспозоны формально относятся к так называемой некодирующей части генома — той, которая в последовательности пар оснований ДНК не несёт информацию об аминокислотных последовательностях белков, хотя некоторые классы мобильных элементов содержат в своей последовательности информацию о ферментах , транскрибируются и катализируют передвижения; например, ДНК-транспозоны и кодируют белки транспозаза , и . У разных видов транспозоны распространены в разной степени: так, у человека транспозоны составляют до 45 % всей последовательности ДНК, у плодовой мухи Drosophila melanogaster часть мобильных элементов составляет лишь 15—20 % всего генома . У растений транспозоны могут занимать основную часть генома — так, у кукурузы ( Zea mays ) с размером генома в 2,3 миллиарда пар оснований по крайней мере 85 % составляют различные мобильные элементы .
История открытия
Барбара Макклинток исследовала вариации окраски зерна и листьев кукурузы, и в 1948 году путём цитологических и генетических исследований пришла к выводу, что мобильные участки ДНК, -элементы, приводят к соматическому мозаицизму растений . Она была первой, кто доказал, что геном эукариот не статичен, а содержит участки, которые могут передвигаться. В 1983 году за эту работу Барбара Макклинток получила Нобелевскую премию .
Хотя транспозоны были открыты в 1940-х годах, только через полвека стало понятно, насколько велика их доля в геноме организмов. Так, получение первой нуклеотидной последовательности ( секвенирование ) генома человека показало, что мобильных элементов в последовательности ДНК не менее 50 %. Точную оценку получить трудно, поскольку некоторые транспозонные участки со временем настолько изменились, что их нельзя уверенно идентифицировать .
Поскольку транспозоны потенциально способны вызывать вредные мутации и поломки хроматина , с начала открытия мобильных элементов считалось, что их действие сводится к геномному паразитизму. Но в начале XXI столетия появляется всё больше данных о возможных благоприятных эффектах транспозонов для организмов , об эволюционном влиянии ретротранспозонов на геном плацентарных млекопитающих . Идентифицируют случаи использования транспозонов организмами. Например, РНК ретротранспозона участвует в образовании гетерохроматина во время инактивации X-хромосомы . Плодовая муха не имеет теломеразы , а вместо этого использует обратную транскриптазу ретротранспозонов для продления теломерных участков, которые у Drosophila melanogaster представлены повторами транспозонов .
Типы транспозонов и механизмы их передвижения

Мобильные генетические элементы относятся к повторяющимся элементам генома — тем, которые имеют несколько копий в последовательности ДНК клетки . Повторяющиеся элементы генома могут располагаться в тандеме ( микросателлиты , теломеры и т. д.) и могут быть рассеяны по геному (мобильные элементы, псевдогены и т. д.) .
Мобильные генетические элементы по типу транспозиции можно разделить на два класса: ДНК-транспозоны , которые применяют метод «вырезать и вставить», и ретротранспозоны , передвижение которых имеет в своем алгоритме синтез РНК из ДНК с последующим обратным синтезом ДНК из молекулы РНК, то есть метод «копировать и вставить».
Транспозоны также можно разделить по степени автономности. Как ДНК-транспозоны, так и ретротранспозоны имеют автономные и неавтономные элементы. Неавтономные элементы для транспозиции нуждаются в ферментах, которые кодируются автономными элементами, которые часто содержат значительно изменённые участки транспозонов и дополнительные последовательности. Количество неавтономных транспозонов в геноме может значительно превышать количество автономных .
ДНК-транспозоны

I. ДНК-транспозоны: способ передвижения «вырезать и вставить».
II. ДДП-1-ретротранспозоны: способ передвижения «копировать и вставить».
ДНК-транспозоны передвигаются по геному способом «вырезать и вставить» благодаря комплексу ферментов под названием транспозаза . Информация об аминокислотной последовательности белка транспозазы закодирована в последовательности транспозона. Кроме того, этот участок ДНК может содержать другие, связанные с транспозоном последовательности, например гены или их части. Большинство ДНК-транспозонов имеют неполную последовательность. Такие транспозоны не являются автономными и передвигаются по геному благодаря транспозазе, которая закодирована другим, полным, ДНК-транспозоном .
На концах участков ДНК-транспозона расположены инвертированные повторы, которые являются особыми участками узнавания транспозазы, таким образом отличая эту часть генома от остальных. Транспозаза способна делать двухцепочные разрезы ДНК, вырезать и вставлять в ДНК-мишень транспозон .
К ДНК-транспозонам принадлежат -элементы растений, которые были впервые открыты Барбарой Макклинток в кукурузе. Ac -элемент ( англ. Activator) является автономным и кодирует транспозазу. Есть несколько типов Ds -элементов, которые способны к формированию разрывов хромосом и которые перемещаются по геному благодаря Ac -элементам .
Гелитроны ( англ. Helitron) — тип транспозонов, который есть у растений , животных и грибов , но который широко представлен в геноме кукурузы, где он, в отличие от других организмов, находится в частях ДНК, богатых генами . Гелитроны транспозируются по механизму «катящегося кольца» ( англ. rolling circle). Процесс начинается с разрыва одной цепи ДНК-транспозоны. Высвобожденный участок ДНК вторгается в последовательность-мишень, где формируется гетеродуплекс . С помощью ДНК-репликации завершается внедрение транспозона в новый участок .
Гелитроны могут захватывать соседние последовательности при транспозиции.
Ретротранспозоны
Ретротранспозоны — это мобильные генетические элементы, которые применяют метод «копировать и вставить» для распространения в геноме животных . По крайней мере 45 % генома человека составляют ретротранспозоны и их производные. Процесс передвижения включает промежуточную стадию молекулы РНК , которая считывается с участка ретротранспозона и которая затем, в свою очередь, используется как матрица для обратной транскрипции в последовательность ДНК. Новосинтезированный ретротранспозон встраивается в другой участок генома.
Активные ретротранспозоны млекопитающих делятся на три основные семьи: Alu-повторы, ДДП-1, SVA.

-
ДДП-1-ретротранспозоны
— длинные диспергированные повторы — тип ретротранспозонов, который широко распространён у млекопитающих и составляет до 20 % генома. ДДП-1 -элементы имеют длину около 6 тысяч пар оснований
. Большинство этих ретротранспозонов в геноме представлено неполно, хотя существует примерно 150 полных и потенциально мобильных ДДП-1-элементов в последовательности ДНК человека и примерно 3000 — у мыши
.
Процесс передвижения начинается со считывания молекулы РНК с элемента ДДП-1. РНК транспортируется к цитоплазме , где от неё транслируются белки (который является РНК-связывающим белком) и (который является белком с эндонуклеазной и возвратно-транскриптазной активностями). БОРС1, БОРС2 и РНК транспозона формируют рибонуклеопротеин и импортируются в ядро , где происходит обратная транскрипция ретротранспозона .
Большинство случаев вставки ДДП-1-элементов происходит не до конца, и такие копии больше не способны к самостоятельной мобилизации .
Существуют сведения о неканонических функциях ДДП-1-элементов во время инактивации X-хромосомы . - ДКП — длинные концевые повторы — ретротранспозоны, имеющие конечные повторяющиеся последовательности, которые играют важную роль в транскрипции и обратной транскрипции РНК транспозона . ДКП-элементы кодируют белки pol и gag , которые близки к белкам ретровирусов, но, в отличие от последних, ДКП не хватает белков, которые смогли бы сформировать внешнюю оболочку ( суперкапсид ) и выйти из клетки .
- КДП — короткие диспергированные повторы являются неавтономными ретротранспозонами: они требуют активности ДДП-1-элементов для передвижения, в ДНК-последовательности КДП содержат только участок связывания РНК-полимеразы . В число КДП входят Alu-ретротранспозоны.

-
Alu-повтор
(
Alu
от
Arthrobacter luteus
) — широко распространённые мобильные элементы в геноме человека
. Alu-элементы имеют длину около 300 пар оснований и часто расположены в
интронах
, участках генома, которые не транслируются, и межгенных участках
. Приставку
Alu-
ретротранспозоны получили за то, что они содержат последовательность распознавания рестрикционного
энзима
AluI
. Анализ последовательностей показал, что Alu-элементы возникли у
приматов
примерно 65 миллионов лет назад от гена 7SL РНК, который входит в рибосомный комплекс
. Alu-ретротранспозоны не имеют собственной обратной транскриптазы, поэтому для передвижения им необходимые ферменты ДДП-1-элементов.
Alu-элементы являются участками, где происходит до 90 % всех случаев A - I редактирования РНК . - — мобильные элементы длиной в 2-3 тысячи пар оснований ДНК, состоящие из нескольких частей: коротких разбросанных элементов (КДП), вариабельного числа тандемных повторов (ВЧТП), Alu-последовательностиі и CT-повтора, с последовательностью CCCTCT, которая встречается чаще всего и имеет название гексамер (Hex) . SVA элементы значительно варьируют в длину из-за разного количества составляющих повторов . Они не являются автономными и нуждаются в белках, закодированных в ДДП1 ретротранспозонах для передвижения, но они активны в геноме человека . SVA-элементы претерпевают высокий уровень метилирования ДНК в большинстве тканей человека. Интересным фактом является заниженное метилирование ДНК SVA-ретротранспозонов в мужских половых клетках человека, тогда как у шимпанзе SVA-последовательности сперматозоидов высоко метилированы .
Механизмы блокировки транспозонов
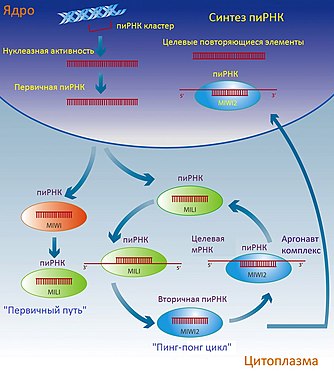
Мобильные элементы генома достаточно широко представлены в растительных и животных геномах. Их высокая активность является риском для стабильности генома , поэтому их экспрессия жестко регулируется, особенно в тех тканях , которые принимают участие в формировании гамет и передаче наследственной информации потомкам. У растений и животных регуляция активности мобильных элементов генома происходит путём de novo - метилирования последовательности ДНК и активности некодирующих РНК вместе с белковыми комплексами Аргонавт .
Основная роль малых некодирующих РНК, которые взаимодействуют с пиви-комплексом, или пиРНК , заключается в подавлении мобильных элементов генома в зародышевых тканях. Эта роль пиРНК достаточно высоко консервативна у животных .
У мышей мобильные элементы генома на протяжении онтогенеза находятся преимущественно в неактивном состоянии, которое достигается путём эпигенетических взаимодействий и активности некодирующих РНК . В период эмбрионального развития эпигенетическая метка метилирования ДНК подвергается репрограммированию: родительские метки стираются, а новые устанавливаются . В этот период часть белков-аргонавтов — пиви-белки (Mili и Miwi2) — и некодирующие РНК, которые с ними взаимодействуют — пиРНК — играют ключевую роль в de novo подавлении ретротранспозонов мышей путём метилирования ДНК, и пинг-понг-цикла амплификации пиРНК, и подавления мишени . Если у мышей возникает недостаток белков Mili и Miwi2, это приводит к активации и и остановке гаметогенеза и стерильности у самцов . Недавние работы показали, что у мухи Drosophila melanogaster активным кофактором в подавлении является белок .
Механизм пиРНК -индуцированного подавления транспозонов окончательно не выяснен, но схематически его можно представить такой моделью :
- первичное накопление одноцепочечных молекул РНК, пиРНК- прекурсоров ;
- созревание пиРНК и их амплификация с помощью пиви-белков (пинг-понг-цикл);
- подавление целевого транспозона, что может происходить несколькими путями: деградация РНК (с помощью РНКазной активности H-подобного домена белков-аргонавтов), подавление трансляции и привлечение хроматин -модифицирующих систем (таких, как белки SWI/SNF ) и дальнейшее эпигенетическое подавление транспозона.
В отличие от вирусов , которые используют организм хозяина для размножения и способны его покинуть, мобильные генетические элементы существуют исключительно в организме хозяина. До некоторой степени поэтому транспозоны способны регулировать свою активность. Примером этого является Ac - ДНК-транспозоны — автономные мобильные элементы растений, кодирующие собственную транспозазу. Ac -элементы проявляют способность снижать активность транспозазы при увеличении её копий .
Также подавление растительных автономных ДНК-транспозонов MuDR может происходить с помощью Muk. Muk является вариантом MuDR и имеет в своей последовательности несколько палиндромных участков ДНК. Когда Muk транскрибируется, такая РНК формирует шпильку, затем режется комплексом ферментов на малые интерферирующие РНК (миРНК), которые заглушают активность MuDR с помощью процесса РНК-интерференции .
Болезни
По состоянию на 2012 год задокументировано 96 различных заболеваний человека, причиной которых является de novo внедрение мобильных генетических элементов . Alu-повторы часто вызывают хромосомные аберрации и являются причиной 50 разновидностей заболеваний . Так, у нейрофиброматоза I типа было найдено 18 случаев встроенных ретротранспозонов , 6 из которых происходят в 3 специфических местах. Активность мобильных элементов в соматических тканях зафиксирована у пациентов с раком легких .
Если транспозиция, которая вызывает заболевания, происходит в гаметах , то следующие поколения наследуют болезни. Так, гемофилия может возникать из-за встраивания ретротранспозона ДДП-1 в участок ДНК, кодирующий ген VIII фактора свертывания крови . У мышей были зафиксированы случаи онкогенеза, остановки развития и стерильность в связи со встраиванием мобильных элементов генома .
Эволюционная роль транспозонов
Некоторые этапы эволюционирования организмов были вызваны активностью мобильных элементов генома. Уже первая нуклеотидная последовательность генома человека доказала, что многие гены были производными транспозонов . Мобильные элементы генома могут влиять на организацию генома путём рекомбинации генетических последовательностей и входя в состав таких фундаментальных структурных элементов хроматина , как центромеры и теломеры . Мобильные элементы могут влиять на соседние гены, меняя узоры ( паттерны ) сплайсинга и полиаденилирования или выполняя функции энхансеров или промоторов . Транспозоны могут влиять на структуру и функции генов путём выключения и изменения функций, изменения структуры генов, мобилизации и реорганизации фрагментов генов и изменения эпигенетического контроля генов .
Репликация транспозонов может вызвать некоторые заболевания, но, несмотря на это, в процессе эволюции транспозоны не были удалены и остались в ДНК -последовательностях почти всех организмов, или в виде целых копий, которые имели возможность передвигаться по ДНК, или в укороченном виде, потеряв способность к передвижению. Но укороченные копии также могут принимать участие в таких процессах, как пост-транскрипционная регуляция генов, рекомбинация и т. п. Также важным моментом в потенциальной способности транспозонов влиять на темпы эволюции является то, что их регуляция зависит от эпигенетических факторов. Это приводит к возможности транспозонов реагировать на изменения окружающей среды и вызывать генетическую нестабильность . На стресс транспозоны активируются или прямо, или путём снижения их подавления белками-аргонавтами и пиРНК . У растений мобильные генетические элементы очень чувствительны к различным типам стресса, на их активность могут влиять многочисленные абиотические и биотические факторы , среди которых солёность , ранения, холод, тепло, бактериальные и вирусные инфекции .
Ещё одним возможным механизмом эволюции геномов организмов является горизонтальный перенос генов — процесс передачи генов между организмами, которые не находятся в отношениях «предки-потомки». Есть сведения о том, что взаимодействия паразитических организмов и животных-хозяев могут повлечь горизонтальный перенос генов с помощью транспозонов, который состоялся между позвоночными и беспозвоночными организмами .
Примеры эволюционной роли мобильных генетических элементов
Считается, что приобретённый иммунитет млекопитающих возник у челюстных рыб примерно 500 миллионов лет назад . Приобретённый иммунитет позволяет формировать антитела для многих видов патогенов , попадающих в организм млекопитающих, включая человека. Для формирования различных антител клетки иммунной системы изменяют последовательность ДНК путём соматической рекомбинации с помощью системы, которая возникла и эволюционировала благодаря мобильным элементам генома .
Нейроны , клетки нервной системы, могут иметь , то есть последовательность ДНК у них отличается от последовательности ДНК других клеток, хотя все они сформировались из одной клетки-предшественника — зиготы . Доказано, что у крыс специально вставленные -ретротранспозоны человека активны даже в зрелом возрасте. Также зафиксировано увеличение копий ДДП-1-ретротранспозонов в нейронах некоторых участков мозга , в частности гипоталамуса , по сравнению с другими тканями у взрослых людей . Также установлено, что мобильные элементы приводят к разнородности в нейронах мухи Drosophila melanogaster . Активность мобильных элементов в нейронах может повлечь синаптическую пластичность и большую вариабельность поведенческих реакций .
Последовательности ДНК генов теломеразы и ДДП-1-ретротранспозонов имеют высокую гомологию, что свидетельствует о возможности происхождения теломераз от ретротранспозонов .
У растений очень большая скорость эволюции геномов, поэтому лучше всего известны те влияния мобильных элементов, которые возникли вследствие одомашнивания , поскольку оно произошло недавно, и эти изменения легко идентифицировать, поскольку известны черты, по которым велась селекция культурных растений . Примером может быть приобретение овальной формы римским помидором Solanum lycopersicum . Ген, который находится в локусе SUN, был перемещён путём ретротранспозиции в другой участок ДНК, где он регулируется другими промоторными последовательностями у овальных томатов .
Использование транспозонов
Генная инженерия
Поскольку мобильные элементы генома способны к встраиванию в хроматин , они используются в генной инженерии для специального и контролируемого встраивания генов или участков ДНК, которые изучают учёные. Транспозоны используются для мутагенеза и для определения регуляторных элементов генома в лабораториях.
Наиболее известная система для введённого мутагенеза in vivo — P-мобильный элемент мухи D. melanogaster , с помощью которого можно изучать функции генов, налаживание хромосомных аберраций и т. п.
У позвоночных животных долгое время не было эффективной методики транспозонной модификации генома. Сейчас есть система мобильного элемента Tol2, полученная из японской рыбы Oryzias latipes , которая используется как у мышей, так и на клеточных линиях человека . Также успешной является система транспозонов Minos .
Система транспозонов «Спящая Красавица» ( англ. Sleeping Beauty) была создана на основе последовательности ДНК транспозазы из рыбы. Удачное использовании этой системы на мышах позволило определить кандидатов в онкогены рака кишечника человека .
Филогенетика
Кроме использования транспозонов в генной инженерии, изучение активности транспозонов является методом филогенетики . Путём анализа и сопоставления нуклеотидных последовательностей геномов различных видов можно найти транспозоны, которые имеются у одних видов, но отсутствуют у других. Виды, у которых есть одинаковый ретротранспозон, скорее всего получили его от общего предка. Таким образом, можно получить информацию об эволюционном развитии видов и строить филогенетические деревья .
Примечания
- ↑ Сиволоб А. В. . — Київ: Видавничо-поліграфічний центр «Київський університет», 2008. — 384 с.
- ↑ Perrat P. N., DasGupta S., Wang J. et al. Transposition-Driven Genomic Heterogeneity in the Drosophila Brain (англ.) // Science : journal. — 2013. — Vol. 340 , no. 6128 . — P. 91—95 . — ISSN . — doi : .
- ↑ Patrick S. Schnable, Doreen Ware, Robert S. Fulton, et al. The B73 maize genome: complexity, diversity, and dynamics (англ.) // Science : journal. — 2009. — Vol. 326 , no. 5956 . — P. 1112—1115 . — doi : . — .
- ↑ Levin Henry L., Moran John V. Dynamic interactions between transposable elements and their hosts (англ.) // Nature Reviews Genetics : journal. — 2011. — Vol. 12 , no. 9 . — P. 615—627 . — ISSN . — doi : .
- Nobel Prize to Barbara McClintock (англ.) // Nature. — 1983. — Vol. 305 , no. 5935 . — P. 575—575 . — ISSN . — doi : .
- ↑ Lander Eric S., Linton Lauren M., Birren Bruce. Initial sequencing and analysis of the human genome (англ.) // Nature : journal. — 2001. — Vol. 409 , no. 6822 . — P. 860—921 . — ISSN . — doi : .
- ↑ Singer Tatjana, McConnell Michael J., Marchetto Maria C.N. et al. LINE-1 retrotransposons: mediators of somatic variation in neuronal genomes? (англ.) // (англ.) (: journal. — Cell Press , 2010. — Vol. 33 , no. 8 . — P. 345—354 . — ISSN . — doi : .
- Kaneko-Ishino Tomoko, Ishino Fumitoshi. Retrotransposon silencing by DNA methylation contributed to the evolution of placentation and genomic imprinting in mammals (англ.) // Development, Growth & Differentiation : journal. — 2010. — Vol. 52 , no. 6 . — P. 533—543 . — ISSN . — doi : .
- ↑ Melamed Esther, Arnold Arthur P. The role of LINEs and CpG islands in dosage compensation on the chicken Z chromosome (англ.) // Chromosome Research : journal. — 2009. — Vol. 17 , no. 6 . — P. 727—736 . — ISSN . — doi : .
- Abad J. P. TAHRE, a Novel Telomeric Retrotransposon from Drosophila melanogaster, Reveals the Origin of Drosophila Telomeres (англ.) // (англ.) (: journal. — Oxford University Press , 2004. — Vol. 21 , no. 9 . — P. 1620—1624 . — ISSN . — doi : .
- Nick Fulcher, Elisa Derboven, Sona Valuchova & Karel Riha. If the cap fits, wear it: an overview of telomeric structures over evolution (англ.) // Cellular and molecular life sciences : CMLS : journal. — 2013. — doi : . — .
- ↑ Batzer Mark A., Deininger Prescott L. Alu repeats and human genomic diversity (англ.) // Nature Reviews Genetics : journal. — 2002. — Vol. 3 , no. 5 . — P. 370—379 . — ISSN . — doi : .
- ↑ R. Keith Slotkin, Robert Martienssen. Transposable elements and the epigenetic regulation of the genome (англ.) // Nature reviews. Genetics : journal. — 2007. — April (vol. 8 , no. 4). — P. 272—285 . — doi : . — .
- van Opijnen Tim, Camilli Andrew. Transposon insertion sequencing: a new tool for systems-level analysis of microorganisms (англ.) // Nature Reviews Microbiology : journal. — 2013. — Vol. 11 , no. 7 . — P. 435—442 . — ISSN . — doi : .
- Chunguang Du, Andrew Hoffman, Limei He, Jason Caronna & Hugo K. Dooner. The complete Ac/Ds transposon family of maize (неопр.) // BMC genomics. — 2011. — Т. 12 . — С. 588 . — doi : . — .
- ↑ Damon Lisch. How important are transposons for plant evolution? (англ.) // Nature reviews. Genetics : journal. — 2013. — Vol. 14 , no. 1 . — P. 49—61 . — doi : . — .
- Baillie J. Kenneth, Barnett Mark W., Upton Kyle R. Somatic retrotransposition alters the genetic landscape of the human brain (англ.) // Nature : journal. — 2011. — Vol. 479 , no. 7374 . — P. 534—537 . — ISSN . — doi : .
- ↑ Cordaux Richard, Batzer Mark A. The impact of retrotransposons on human genome evolution (англ.) // Nature Reviews Genetics : journal. — 2009. — Vol. 10 , no. 10 . — P. 691—703 . — ISSN . — doi : .
- Stower Hannah. Alternative splicing: Regulating Alu element 'exonization' (англ.) // Nature Reviews Genetics : journal. — 2013. — Vol. 14 , no. 3 . — P. 152—153 . — ISSN . — doi : .
- Varki Ajit, Geschwind Daniel H., Eichler Evan E. Human uniqueness: genome interactions with environment, behaviour and culture (англ.) // Nature Reviews Genetics : journal. — 2008. — Vol. 9 , no. 10 . — P. 749—763 . — ISSN . — doi : .
- ↑ Hancks D. C., Mandal P. K., Cheung L. E. et al. The Minimal Active Human SVA Retrotransposon Requires Only the 5'-Hexamer and Alu-Like Domains (англ.) // (англ.) (: journal. — 2012. — Vol. 32 , no. 22 . — P. 4718—4726 . — ISSN . — doi : .
- ↑ Hancks Dustin C., Kazazian Haig H. Active human retrotransposons: variation and disease (англ.) // Current Opinion in Genetics & Development : journal. — 2012. — Vol. 22 , no. 3 . — P. 191—203 . — ISSN . — doi : .
- Law Julie A., Jacobsen Steven E. Establishing, maintaining and modifying DNA methylation patterns in plants and animals (англ.) // Nature Reviews Genetics : journal. — 2010. — Vol. 11 , no. 3 . — P. 204—220 . — ISSN . — doi : .
- ↑ Siomi Mikiko C., Sato Kaoru, Pezic Dubravka et al. PIWI-interacting small RNAs: the vanguard of genome defence (англ.) // Nature Reviews Molecular Cell Biology : journal. — 2011. — Vol. 12 , no. 4 . — P. 246—258 . — ISSN . — doi : .
- De Fazio Serena, Bartonicek Nenad, Di Giacomo Monica. The endonuclease activity of Mili fuels piRNA amplification that silences LINE1 elements (англ.) // Nature : journal. — 2011. — Vol. 480 , no. 7376 . — P. 259—263 . — ISSN . — doi : .
- Popp Christian, Dean Wendy, Feng Suhua. Genome-wide erasure of DNA methylation in mouse primordial germ cells is affected by AID deficiency (англ.) // Nature : journal. — 2010. — Vol. 463 , no. 7284 . — P. 1101—1105 . — ISSN . — doi : .
- Castel Stephane E., Martienssen Robert A. RNA interference in the nucleus: roles for small RNAs in transcription, epigenetics and beyond (англ.) // Nature Reviews Genetics : journal. — 2013. — Vol. 14 , no. 2 . — P. 100—112 . — ISSN . — doi : .
- Luteijn Maartje J., Ketting René F. PIWI-interacting RNAs: from generation to transgenerational epigenetics (англ.) // Nature Reviews Genetics : journal. — 2013. — Vol. 14 , no. 8 . — P. 523—534 . — ISSN . — doi : .
- ↑ Damon Lisch. Regulation of transposable elements in maize (неопр.) // Current opinion in plant biology. — 2012. — Т. 15 , № 5 . — С. 511—516 . — doi : . — .
- ↑ Zamudio N., Bourc'his D. Transposable elements in the mammalian germline: a comfortable niche or a deadly trap? (англ.) // Heredity : journal. — 2010. — Vol. 105 , no. 1 . — P. 92—104 . — ISSN . — doi : .
- ↑ Rebollo Rita, Horard Béatrice, Hubert Benjamin et al. Jumping genes and epigenetics: Towards new species (англ.) // (англ.) (. — Elsevier , 2010. — Vol. 454 , no. 1—2 . — P. 1—7 . — ISSN . — doi : .
- Gilbert Clément, Schaack Sarah, Pace II John K. et al. A role for host–parasite interactions in the horizontal transfer of transposons across phyla (англ.) // Nature : journal. — 2010. — Vol. 464 , no. 7293 . — P. 1347—1350 . — ISSN . — doi : .
- ↑ Flajnik Martin F., Kasahara Masanori. Origin and evolution of the adaptive immune system: genetic events and selective pressures (англ.) // Nature Reviews Genetics : journal. — 2009. — Vol. 11 , no. 1 . — P. 47—59 . — ISSN . — doi : .
- Coufal Nicole G., Garcia-Perez José L., Peng Grace E. L1 retrotransposition in human neural progenitor cells (итал.) // Nature : diario. — 2009. — V. 460 , n. 7259 . — P. 1127—1131 . — ISSN . — doi : .
- ↑ Carlson Corey M., Largaespada David A. Insertional mutagenesis in mice: new perspectives and tools (англ.) // Nature Reviews Genetics : journal. — 2005. — Vol. 6 , no. 7 . — P. 568—580 . — ISSN . — doi : .
- Venken Koen J T., Schulze Karen L., Haelterman Nele A. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes (англ.) // Nature Methods : journal. — 2011. — Vol. 8 , no. 9 . — P. 737—743 . — ISSN . — doi : .
- March H Nikki, Rust Alistair G., Wright Nicholas A. Insertional mutagenesis identifies multiple networks of cooperating genes driving intestinal tumorigenesis (англ.) // Nature Genetics : journal. — 2011. — Vol. 43 , no. 12 . — P. 1202—1209 . — ISSN . — doi : .
- , < >
Глоссарий
- Ac/Ds — система активации-диссоциации ( англ. Activator-dissocation system)
- БОРС1 — белок первой открытой рамки считывания ( англ. Open reading frame 1 protein, ORF1p); БОРС2 — белок второй открытой рамки считывания
- ДДП — длинные диспергированные повторы ( англ. Long INterspersed Elements, LINE, L)
- ДКП — длинные концевые повторы ( англ. Long Terminal Repeat, LTR)
- КДП — короткие диспергированные повторы ( англ. Short INterspersed Elements, SINE)
- SVA ( англ. SINE-R-VNTR-Alu) — элементы КДП-ВЧТП-Alu (где ВЧТП — варьирующие по числу тандемные повторы , англ. Variable number of tandem repeat, VNTR).
- СФГ-1 — специфический фактор гаметоцитов-1 ( англ. gametocyte-specific factor 1, GTSF1)
Литература
- Голубовский М. Д. // Историко-биологические исследования. 2011. № 4. С.60-78.
- Титов И.И., Ворожейкин П.С. // Вавиловский журнал генетики и селекции. — Т. 15 , № 323—326 .
- Авдеев Ю. И., Авдеев А. Ю. // нет. 2013. № 2. С.103-109.
- Данилевская О. Н. // Историко-биологические исследования. 2011. № 4. С.79-89.
- Юрченко Н. Н., Коваленко Л. В., Захаров И. К. // Вавиловский журнал генетики и селекции. — Т. 15 , № 2 . — С. 261—270 .
См. также
- 2020-05-15
- 1



