Ферросиликомарганец
- 1 year ago
- 0
- 0

| 25 |
????????
|
|
|
|
| 3d 5 4s 2 | |
????????? ( ?????????? ?????? — Mn , ?? ???. Manganum ) — ?????????? ??????? 7-? ?????? (?? ?????????? ????????????? — ???????? ????????? ??????? ??????, VIIB), ?????????? ??????? ????????????? ??????? ?????????? ????????? ?. ?. ?????????? , ? ??????? ??????? 25.
??????? ???????? ???????? — ??? ???????, ?? ???????????? ? ????, ??????? ?????????? ?????? ?????????? - ?????? ?????. ????????? ? ??????? ???????? .
???? ?? ???????? ????????? ???????? — ????????? — ??? ???????? ? ????????? ??? ?????? ???????? ? ????????????? ??? ????? ?????? ??? ??? ??????????. ??? ??????? ?????????????? ?????????? ????????? , ? ??? ????, ??? ?? ?? ????????????? ???????? , ?????? ??????? ???????? ??????? ????? ?????? ????????, ? ???????? ?????? «??????????». ? 1774 ???? ???????? ????? ?. ????? ???????, ??? ? ???? ?????????? ??????????? ??????. ?? ?????? ??????? ???? ?????? ????? ?????? ?. ???? , ???????, ???????? ? ????? ????????? ? ?????, ??????? ????????????? ????????. ? ?????? XIX ???? ??? ???? ???? ??????? ???????? «????????» ( ???. ???????? ?????????? ?? ???. Manganerz — ??????????? ????).
???????? — 14-? ??????? ?? ?????????????????? ?? ????? , ? ????? ?????? — ?????? ??????? ?????? , ???????????? ? ?????? ???? (0,03 % ?? ?????? ????? ?????? ?????? ????). ???????? ???? ???????? ????????????? ?? ?????? (600 ?/?) ? ???????? ??????? (2,2 ??/?). ??????????? ?????? ?? ?????? ??? ????? , ?????? ??????????? ? ??????????????? ????????????? ????????. ? ?????????? ????????????? (????? ??????? ) ????????????? ?? 40 % ??????????? ???. ????????, ?????????? ? ?????? ???????, ?????????? ????? ? ???????? ? ??????? ?????. ??? ???? ??? ?????????? ? ??????? ???? ????????????? (10 ?7 —10 ?6 %), ? ? ???????? ?????? ?????? ??? ???????????? ?????????? ?? 0,3 % ?????????? ????????? ???????????? ? ???? ?????????? ? ???????????? ?????????????? ? ???? ?????? ????????, ??????? ? ??????????????? ????? (MnO 2 · x H 2 O) ? ?????????? ? ?????? ???? ??????, ???????? ??? ?????????? ????????????????? ????????? ?? ???, ? ??????? ?????????? ???????? ????? ????????? 45 % (????? ? ??? ??????? ??????? ???? , ?????? , ???????? ). ????? ????????? ????? ????? ? ??????? ?????????? ???????? ??? ??????????????.
? ?????? ???????? ??????????????? ??????, ???????? ?????????????: «????????» ? ??????????? ???????, «??????????» ? ????????????, «???????????» ? ???????????? ????, «????-??????????» ? ????????? ?????????? ???????, «????????-??????????» ??????? ? «??????-??????????» ???? ?? ????? ?????.
???????? ???? ??????????? ??????????? ???????? — ?????? ? ?????????? ? ???? ? ?????????????? ??????????????? ???????? .
????????? ???????? ????????? ? ???????. ?????? ???????? ????????:
|
??????????
????? |
???????????????
????? |
????? | E 0 , ? |
|---|---|---|---|
| Mn 2+ | Mn | H + | ?1,186 |
| Mn 3+ | Mn 2+ | H + | +1,51 |
| MnO 2 | Mn 3+ | H + | +0,95 |
| MnO 2 | Mn 2+ | H + | +1,23 |
| MnO 2 | Mn(OH) 2 | OH ? | ?0,05 |
| MnO 4 2? | MnO 2 | H + | +2,26 |
| MnO 4 2? | MnO 2 | OH ? | +0,62 |
| MnO 4 ? | MnO 4 2? | OH ? | +0,56 |
| MnO 4 ? | H 2 MnO 4 | H + | +1,22 |
| MnO 4 ? | MnO 2 | H + | +1,69 |
| MnO 4 ? | MnO 2 | OH ? | +0,60 |
| MnO 4 ? | Mn 2+ | H + | +1,51 |
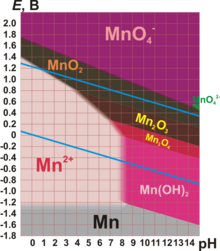
??????????? ??????? ????????? ????????: 0, +2, +3, +4, +6, +7 (??????? ????????? +1, +5 ??????????????, ? ??????? ????????? ?1 ????????? ????? ?????).
??? ????????? ?? ??????? ?????????????. ??????????????? ???????? ??????? ? ?????????:
???????? ??? ??????? ? ?????????? ??????? ?????, ???????? ?????????, ???????? ??????? :
??? ???? ???? ????????????? ?????????? ???????? ????????? ???????.
???????? ????????? ???????, ? ?????????? ??????????? ??? ????????????? ? ???????? ?????????????. ??? ??????????? ???? 1200 °C ??????????????? ? ?????? , ??????? ????????? ?? ??????? ??????? .
??????? ????????? ? ????????????? ?????????, ??????? ??????? Mn 3 C ? ??????. ???????? ????? ???????? , ?????? , ??????? .
? ??????? ? ?????? ????????? ????????? ?? ?????????
? ????????????????? ?????? ???????? ??????? ???? ?? ?????????
? ???????????? ??????? ???????? ??????? ???? ?? ?????????
? ???????? ???????? ???????? ????????.
???????? ???????? ????????? ??????: MnO, Mn 2 O 3 , MnO 2 , MnO 3 (?? ??????? ? ????????? ?????????) ? ??????????? ???????? Mn 2 O 7 .
Mn 2 O 7 ? ??????? ???????? — ?????? ??????????? ???????? ?????-???????? ?????, ????? ????????????; ? ????? ? ????????????????? ?????? ???????? ???????????? ???????????? ????????. ??? 90 °C Mn 2 O 7 ??????????? ?? ???????. ???????? ????????? ?????? Mn 2 O 3 ? MnO 2 , ? ????? ??????????????? ????? Mn 3 O 4 (2MnO·Mn 2 O 3 , ??? ???? Mn 2 MnO 4 ).
??? ?????????? ?????? ???????? (IV) ( ????????? ) ?? ???????? ? ??????????? ????????? ?????????? ????????? :
??????? ????????? ????? ?????-??????? ????. ??? ??????????? ????????? ???????
??????? ???????????? ? ????????? ???? ??-?? ????????? ?????? MnO 4 ? , ? ?? ???? ???????? ?????????? ?????? ??????-?????????? ???????? (IV).
??????????? ??????? ????? ???????, ?? ????????????, ?? ?????????? ???????????????? ????? ??? ?? 20 %. ???? ??????? ? ?? ???? ( ???????????? ) — ??????? ??????????. ????????, ??????????? ????? ? ??????????? ?? pH ???????? ???????? ????????? ????????, ???????????????? ?? ?????????? ???????? ?????? ??????? ?????????. ? ?????? ????? — ?? ?????????? ???????? (II), ? ??????????? — ?? ?????????? ???????? (IV), ? ?????? ???????? — ?? ?????????? ???????? (VI).
??? ???????????? ???????????? ??????????? ? ?????????? ????????? (???? ?? ???????????? ???????? ????????? ??????? ?????????). ??????? ???? ?? ????????? (?? ??????? ???????????? ?????)
??? ????????? ??????? ??????????? ??? Mn 2+ ????????? ? ??? MnO 4 ? :
??? ??????? ???????????? ??? ????????????? ??????????? Mn 2+ (??. ? ??????? «??????????? ???????? ??????????? ???????»).
??? ?????????????? ????????? ????? Mn (II) ?? ??? ???????? ?????? ?????????? ???????? (II), ?????? ???????? ?? ??????? ? ?????????? ?????????. ????????? ???????? ??????? ??. ? ??????? «??????????? ???????? ??????????? ???????». ? ??????????? ??? ?????? ?????? ????????? ??? Mn 2+ ???????? ?????????? ? ??????-??????? ???? ???????????? [Mn(H 2 O) 6 ] 2+ .
???? MnCl 3 , Mn 2 (SO 4 ) 3 ???????????. ?????????? Mn(OH) 2 ? Mn(OH) 3 ????? ???????? ????????, MnO(OH) 2 — ??????????. ?????? ???????? (IV) MnCl 4 ????? ??????????, ??????????? ??? ??????????, ??? ?????????? ??? ????????? ????? :
??????? ??????? ????????? ? ???????? ??????????? ? ??????????? ? ?-????????? ? ?-???????????? ?????????. ???, ??? ???????? ? ???????? ???????? ??????? Mn 2 (CO) 10 .
???????? ? ?????? ?????????? ???????? ? ?-????????? ? ?-???????????? ????????? (PF 3 , NO, N 2 , P(C 5 H 5 ) 3 ).
?????????????:
???????? ???????? ????????????? ????????? — ? ??????? ?????????? ?????? ???? ?????????? ?????? 55 Mn. ??? ?????? ??????? ???????? ??????????? ? ???????????? , ??? ???????? ????????????. ???????? 25 ????????????? ???????? ????????, ??????? ???????? ????? ? ? ????????? ?? 44 ?? 70. ???????? ??????????? ?? ??? ???????? 53 Mn (?????? ??????????? T 1/2 = 3,7 ??? ??? ), 54 Mn ( T 1/2 = 312,3 ????? ) ? 52 Mn ( T 1/2 = 5,591 ????? ). ????????????? ??????? ??????? ?????? ???????? ???????? ( ? < 55 ) ???????? ??????????? ?????? (? ?????? ????????????? ? ??? ??????????? ?????? ) ? ??????????????? ??????? ?????. ? ??????? ???????? ( ? > 55 ) ???????? ??????? ??????? ???????? ? ? -?????? ? ??????????????? ??????? ??????. ???????? ????? 7 ???????? (?????????????? ???????????? ?????????) ? ????????? ??????????? ????? 100 ?? .
???????? ? ???? ????????????? ??????????? ??? ??????????? ????? ??? ?? ??????, ?? ???? ??? ???????? ?? ??? ?????????. ????? ????, ?? ????????? ???? , ??? ????? ???????? ???????? ??????. ???????? ?? 12—13 % Mn ? ????? (??? ?????????? ????? ????????? ), ?????? ? ????????? ? ??????? ??????????? ?????????, ?????? ????????? ?????, ?????? ?? ??????? ? ???????????????? ?????? ? ?????? (?. ?. « ?????? »). ????? ????? ???????????? ??? ???????????? ??????? ???????, ??????????? ? ??????????????? ?????, ???????? ????????? ? ?. ?. ? «?????????? ?????» ???????? ?? 20 % Mn, ??????????? ??? ???????? ?????.
? 1920—1940-? ????? ?????????? ???????? ????????? ?????????? ???????? ?????. ? ?????? 1950-? ????? ? ??????? «?????» ???????? ????????? ?? ??????? ? ??????????? ???????? ?????????? ???????? ? ??????, ? ??? ????? ?????? ?? ????????? ????????????? ?????????? ???????? ? ???????? ???????????? ??????, ? ???????, ?????? ? ?. ?. ???????? ? ?. ?. ????????????? , ?????? ??????? ?. ?. ??????, ??????? ?? ?????? ???????????????? ????????????? ??????? ?????????????????? ?????????????? ??????????. ????? ?? ??????? ??????????? ??????? ????????????? ???????? ?? ?????????????????? ??????. ? ?????? ???? ???????? ?????????? ???????? ??????????????????? ??????? ? ??????????? .
????? 83 % Cu , 13 % Mn ? 4 % Ni ( ???????? ) ???????? ??????? ?????????????????????, ???? ???????????? ? ?????????? ???????????. ??????? ??? ????????? ??? ???????????? ????????? ? ??.
???????? ?????? ? ?????? ? ?????? .
???????????? ?????????? ???????? ???????? ???????????? ??? ???????????? ??????????- ???????? ?????????????? ????????? , MnO 2 ???????????? ? ????? ????????? ? ???????? ??????????- ?????????????? .
?????????? ???????? ????? ?????? ???????????? ??? ? ?????? ???????????? ??????? (MnO 2 ? KMnO 4 ? ???????? ???????????), ??? ? ???????????? ???????????? ??????? (?????????? ????????????? ????????? ?????????????, ????????, ? ???????????? ???????????? ??????? ?????????? p - ??????? , ????????? ????????? ? ?????? ?????? ???????).
??????? ???????? ???????? ?????????? ??????????????????? ???????? , ????????????? ??? ?????????.
???????? ???????? — ????????????? ?????????????????? ???????? ( ?????-??? 500 ???/?).
???????? ??????????? ? ????? ????????????? ?????? ????????.
????????????? ???????, ???????????? ? ????????????? ????? ??? ??????????? ???????? Mn 2+ , ?????????:
1. ????? ?????? ? ?????? ???????? (II) ???? ????? ?????? ?????????? ???????? (II):
?????? ?? ??????? ?????? ???? ?? ????? ??-?? ????????? ?????????? ???????.
?????????? ???????. ? ???? ?????? ???????? ???? ???????? ????????? ??? ????? ???????? ??????. ????????? ????????? ????? ??????.
2. ???????? ???????? ? ??????????? ?????? ???????? ???? ???????? (II) ?? ?????-?????? ?????????? ???????? (IV):
?????????? ???????. ? ???? ?????? ???????? ???? ???????? ????????? ?????? ????? ???????? ?????? ? ??? ????? ???????? H 2 O 2 .
3. ??????? ?????? PbO 2 ? ??????????? ????????????????? ??????? ??????? ??? ?????????? ???????? Mn 2+ ?? MnO 4 ? ? ???????????? ??????????? ??????? ?????????? ?????:
??? ??????? ???? ????????????? ????????? ? ??????????? ???????????????, ???????? ??????????????? ??????? ? ?? ?????, ??? ??? ??? ??????????????? ? ????????? ??????, ? ????? ? ?????????????? ??????????? ????????. ??? ??????? ??????????? ???????? ???????? ??? ??????? ?? ???????, ??? ??? ??????? ????? Mn 2+ ??????????????? ???????????? ??????????? ??????? HMnO 4 ?? MnO(OH) 2 , ? ?????? ????????? ??????? ?????????? ????? ??????. ?????? ???????? ?????? ??? ????????? Mn 2+ ? MnO 4 ? ????? ???? ???????????? ?????? ??????????, ????????, ?????????? ??????? (NH 4 ) 2 S 2 O 8 ? ??????????? ???????????? — ????? Ag + ??? ???????? ?????? NaBiO 3 :
?????????? ???????. ? ???????? ?????? ?????????? ???????? ??????? PbO 2 , ? ????? 5 ?????? ????????????????? ??????? ??????? HNO 3 ? ????????? ????? ?? ??????? ??????? ????. ? ???????? ????? ????????? 1 ????? ???????? ???????? ???????? (II) MnSO 4 ? ????? ????????? 10—15 ???, ?????????? ????? ?? ??????? ?????????? ????????. ???? ??????? ???????? ?????? ?????? ? ????????? ????????? ??????? ?????????????? ??????????? ???????.
??? ????????? ?????????? ?????? ??????? ???????? ????????? ???????. ? ???????? ???????? 1—2 ????? ???????? ???????? ???????? (II) ? 4 ????? 6 ?. HNO 3 , ????????? ????????? ???????? ????????? ?????? ? ???????????. ????????? ????????? ????????? ??????? ????????.
4. ??????? ??????? (NH 4 ) 2 S ???????? ?? ???????? ????? ???????? ??????? ???????? (II), ?????????? ? ???????? ????:
?????? ????? ???????????? ? ???????????? ??????????? ???????? ? ???? ? ???????? ???????.
?????????? ???????. ? ???????? ???????? 2 ????? ???????? ???? ???????? (II) ? ????????? 2 ????? ???????? ???????? ???????.
???????? ?????????? ? ?????????? ???? ???????? ? ????????, ???? ??? ?????????? ?????? ????? ????, ??????? ???????? ????? ????????, ?? ????????? ???????????? ??????? ?? ?????????????????, ?? ???? ???????? ?????????????? . ???????? ????????? ??????? ?? ????, ??????????? ????? ? ??????? ??????? ????? . ????? ?????? ????????? ?????? ?????? ? ????? ??????? — ?? 0,03 %, ? ????? ??????? ??? ?????????? ?????????? ? ?????????? ????? ???????? — ?? 0,05 %. ????????? ???????? ???????? ?? ?????????? ????????? ????????.
?????????? ?????????? ???????? ? ????????? ???????????, ? ?????? ???????, ?? ???????????????? ??????????? ??????? ???????. ??? ??????????? ? ????????????, ??????????, ????????? ??????? ??????. ???????? ???????? ??????????? ????, ?????????? ????? ??????, ????????-?????????? ? ???????????????? ???????, ???????? ????????????? ? ?????????? ??????.
??????????? ???? ??? ???????? ?????????? 40 ?? ???????? ? ????. ????????? ???? ??? ???????? ?? ??????????.
??? ??????????? ??????????? ???????? ????????? ? ???????? ???????? ??????????????. ???????? ?????????? ?????????? ????????? ? ???????? ???????? ????????? ?????, ????????? ????????, ????????? ??????????? ?????? ? ????????? ??????? ?????.
????????? ? ??????? ?????????? ????????? ? ?????, ????????? ??????? ???? ? ??????? ??????????? ????????, ???. [ ??? ? ????????? ] ? ???????? ?????????? ????? ??????????? ? ??????? ??????????? ????????? ??????? ????????? ???????? ?? ???????????? . ??? ??????????? ? ???? ??????? ????????? ???????, ??????? ??????????????????????, ????????????? ? ???????????? — «??????????? ???????». ? ?????????? ??????????? ????????? ? ???????????????? ???????, ???????? ??????? ??????????.
????? ????????? ??????????? ??????? ???????????? ?????????? ?????????, ?????? ????????? ????????? ???. ??? ??????????????? ?????????? ????????? ??????????? ?????????????? ????????? ? ?????????, ?????????? ?????????? ??????????? ???????? ? ?????????? ????? (? ?????????, ??????????????? ????????????? ????, ?? ?????????? ? ????????? ????).