Interested Article - Ванадий

- 2020-02-09
- 2
| 23 |
Ванадий
|
|
|
|
| 3d 3 4s 2 | |
Вана́дий ( химический символ — V, от лат. V anadium ) — химический элемент 5-й группы (по устаревшей классификации — побочной подгруппы пятой группы, VB), четвёртого периода периодической системы химических элементов Д. И. Менделеева , с атомным номером 23 и атомной массой 50,9415(1) . Элемент относится к переходным металлам .
Простое вещество ванадий — пластичный металл серебристо-серого цвета , покрывается на воздухе красивой плёнкой из оксидов ванадия , разные цвета которой обусловлены разной толщиной оксидного слоя .
История
Ванадий был открыт в 1801 году профессором минералогии из Мехико Андресом Мануэлем Дель Рио в свинцовых рудах. Он обнаружил новый металл и предложил для него название «панхромий» из-за широкого диапазона цвета его соединений, сменив затем название на «эритроний». Дель Рио не имел авторитета в научном мире Европы, и европейские химики усомнились в его результатах. Затем и сам Дель Рио потерял уверенность в своём открытии и заявил, что открыл всего лишь хромат свинца.
В 1830 году ванадий был открыт заново шведским химиком в железной руде. Новому элементу название дали Берцелиус и Сефстрём.
Шанс открыть ванадий был у Фридриха Вёлера , исследовавшего мексиканскую руду, но он серьёзно отравился фтороводородом незадолго до открытия Сефстрёма и не смог продолжить исследования. Однако Вёлер довёл до конца исследование руды и окончательно доказал, что в ней содержится именно ванадий, а не хром .
Названия
Этот элемент образует соединения с красивой окраской, отсюда и название элемента, связанное с именем скандинавской богини любви и красоты Фрейи ( др.-сканд. Vanadís — дочь Ванов; Ванадис ) . В 1831 году геолог предложил переименовать ванадий в «рионий» (в честь Дель Рио), но это предложение не было поддержано .
Нахождение в природе
Ванадий является 20-м по распространённости элементом в земной коре . Он относится к рассеянным элементам и в природе в свободном виде не встречается. Содержание ванадия в земной коре 1,6⋅10 −2 % по массе, в воде океанов 3⋅10 −7 %. Наиболее высокие средние содержания ванадия в магматических породах отмечаются в габбро и базальтах (230—290 г/т). В осадочных породах значительное накопление ванадия происходит в биолитах (асфальтитах, углях, битуминозных фосфатах), битуминозных сланцах, бокситах , а также в оолитовых и кремнистых железных рудах . Близость ионных радиусов ванадия и широко распространённых в магматических породах железа и титана приводит к тому, что ванадий в гипогенных процессах целиком находится в рассеянном состоянии и не образует собственных минералов. Его носителями являются многочисленные минералы титана (титаномагнетит, сфен , рутил , ильменит ), слюды , пироксены и гранаты , обладающие повышенной изоморфной ёмкостью по отношению к ванадию. Важнейшие минералы: патронит VS 4 , ванадинит Pb 5 (VO 4 ) 3 Cl и некоторые другие. Основной источник получения ванадия — железные руды, содержащие ванадий как примесь.
(VO 2+ ) в изобилии находится в морской воде, имея среднюю концентрацию 30 нМа . Некоторые источники минеральной воды также содержат ион в высоких концентрациях. Например, источники около горы Фудзи содержат до 54 мкг ванадия на литр .
Месторождения
В течение первого десятилетия XX века большая часть ванадиевой руды добывалась американской компанией Vanadium из Минас-Рагра в Перу. Позднее увеличение спроса на уран привело к увеличению добычи руды этого металла. Одной из основных урановых руд был карнотит , который также содержит ванадий. Таким образом, ванадий стал доступным как побочный продукт производства урана. Со временем добыча урана стала обеспечивать большую долю спроса на ванадий .
Известны месторождения в Перу, США, ЮАР, Финляндии, Австралии, Армении, Турции, Англии, России . Одним из крупнейших месторождений ванадия называют Чинейское месторождение в Забайкальском крае .
Физические свойства

Ванадий — пластичный металл серебристо-серого цвета , по внешнему виду похож на сталь. Образует кристаллы кубической сингонии (объёмно-центрированная решётка), пространственная группа Im 3 m , параметры ячейки a = 0,3024 нм , Z = 2 . Температура плавления 1920 °C, температура кипения 3400 °C, плотность 6,11 г/см³ . При нагревании на воздухе выше 300 °C ванадий становится хрупким. Примеси кислорода , водорода и азота резко снижают пластичность ванадия и повышают его твёрдость и хрупкость .
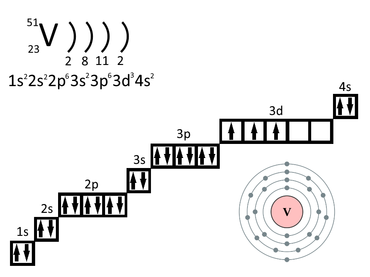
Изотопы
Природный ванадий состоит из двух изотопов : слаборадиоактивного 50 V (изотопная распространённость 0,250 %) и стабильного 51 V (99,750 %). Период полураспада ванадия-50 равен 1,5⋅10 17 лет , то есть для всех практических целей его можно считать стабильным; этот изотоп в 83 % случаев посредством электронного захвата превращается в 50 Ti , а в 17 % случаев испытывает бета-минус-распад , превращаясь в 50 Cr .
Известны 24 искусственных радиоактивных изотопа ванадия с массовым числом от 40 до 65 (а также 5 метастабильных состояний ). Из них наиболее стабильны 49 V ( T 1/2 =337 дней) и 48 V ( T 1/2 =15,974 дня).
Химические свойства
Химически ванадий довольно инертен. Он имеет хорошую стойкость к коррозии, к действию морской воды, разбавленных растворов соляной, азотной и серной кислот, щелочей .
С кислородом ванадий образует несколько оксидов : VO, V 2 O 3 , VO 2 ,V 2 O 5 . Оранжевый V 2 O 5 — кислотный оксид, тёмно-синий VO 2 — амфотерный, остальные оксиды ванадия — осно́вные.
Известны следующие оксиды ванадия:
| Систематическое | Хим. формула | Плотность , г/см³ | Температура плавления , °C | Температура кипения , °C | Молярная масса , г/ моль | Цвет |
|---|---|---|---|---|---|---|
| Оксид ванадия(II) | VO | 5,76 | 1830 | 3100 | 66,94 | Чёрный |
| Оксид ванадия(III) | V 2 O 3 | 4,87 | 1967 | 3000 | 149,88 | Чёрный |
| Оксид ванадия(IV) | VO 2 | 4,571 г/см³ | 1542 | 2700 | 82,94 | Тёмно-голубой |
| Оксид ванадия(V) | V 2 O 5 | 3,357 | 670 | 2030 | 181,88 | Красно-жёлтый |
Галогениды ванадия гидролизуются. С галогенами ванадий образует довольно летучие галогениды составов VX 2 (X = F , Cl , Br , I ), VX 3 , VX 4 (X = F , Cl , Br ), VF 5 и несколько оксогалогенидов (VOCl, VOCl 2 , VOF 3 и др.).
Соединения ванадия в степенях окисления +2 и +3 — сильные восстановители, в степени окисления +5 проявляют свойства окислителей. Известны тугоплавкий карбид ванадия VC (t пл =2800 °C), нитрид ванадия VN, сульфид ванадия V 2 S 5 , силицид ванадия V 3 Si и другие соединения ванадия.
При взаимодействии V 2 O 5 с осно́вными оксидами образуются ванадаты — соли ванадиевой кислоты вероятного состава HVO 3 .
Взаимодействует с кислотами .
- С концентрированной азотной кислотой :
Получение

В промышленности при получении ванадия из железных руд с его примесью сначала готовят концентрат, в котором содержание ванадия достигает 8—16 %. Далее окислительной обработкой ванадий переводят в высшую степень окисления +5 и отделяют легко растворимый в воде ванадат натрия NaVO 3 . При подкислении раствора серной кислотой выпадает осадок, который после высушивания содержит более 90 % ванадия.
Первичный концентрат восстанавливают в доменных печах и получают концентрат ванадия, который далее используют при выплавке сплава ванадия и железа — так называемого феррованадия (содержит от 35 до 80 % ванадия). Металлический ванадий можно приготовить восстановлением хлорида ванадия водородом, термическим восстановлением оксидов ванадия (V 2 O 5 или V 2 O 3 ) кальцием, термической диссоциацией VI 2 и другими методами.
Некоторые из разновидностей асцидий обладают уникальной особенностью: в их крови содержится ванадий. Асцидии поглощают его из воды. В Японии предложено разводить асцидий на подводных плантациях, собирать их урожай, сжигать и получать золу, в которой ванадий содержится в более высокой концентрации, чем в руде многих его месторождений .
Применение
Хлорид ванадия применяется при термохимическом разложении воды в атомно-водородной энергетике (ванадий-хлоридный цикл «Дженерал Моторс», США).
Пентаоксид ванадия широко применяется в качестве положительного электрода (анода) в мощных литиевых батареях и аккумуляторах .
- В производстве серной кислоты
Оксид ванадия(V) используется как катализатор на стадии превращения сернистого ангидрида в серный .
- Металлургия
Свыше 90 % всего производимого ванадия находит применение в качестве легирующей добавки в сталях , главным образом, высокопрочных низколегированных, в меньшей степени, нержавеющих и инструментальных, а также в производстве высокопрочных титановых сплавов , основанных на системе Ti-6Al-4V (в российской классификации — ВТ6, содержит около 4 % ванадия). В сталях ванадий образует мелкодисперсные карбиды VC, что повышает механические свойства и стабильность структуры. Его применение особенно эффективно совместно с вольфрамом, молибденом и никелем. В конструкционных сталях содержание ванадия не превышает, как правило, 0,25 %, в инструментальных и быстрорежущих доходит до 4 %. В российской номенклатуре сталей ванадий обозначается буквой Ф.
Ванадий используется в деталях, требующих очень высокой прочности, таких как поршни автомобильных двигателей. Американский промышленник Генри Форд отмечал важную роль ванадия в автомобильной промышленности. «Если бы не было ванадия — не было бы автомобиля». — Говорил Форд . Ванадиевая сталь позволила уменьшить вес при увеличении прочности при растяжении .
Ванадиевая сталь используется при создании погружных буровых платформ для бурения нефтяных скважин .
- Сувенирная продукция
Частные компании США выпускают медали и коллекционные жетоны из чистого ванадия. Одна из ванадиевых медалей вышла в 2011 году .
- Электроника
Полупроводниковый материал на основе диоксида ванадия применяют для термисторов , переключателей элементов памяти и дисплеев .
Производство
- Россия : Евраз Ванадий Тула, Чусовской металлургический завод
- Чехия : Мнишек-под-Брди
- США : Хот-Спрингс
- ЮАР : Бритс
Биологическая роль и воздействие

|
|
Этот раздел
не завершён
.
|
Ванадий и многие его соединения токсичны (для человека ) в высоких концентрациях. Наиболее токсичны соединения пятивалентного ванадия. Ядовит его оксид(V) V 2 O 5 (ядовит при попадании внутрь организма и при вдыхании поражает дыхательную систему). Полулетальная доза ЛД50 оксида ванадия(V) для крыс перорально составляет 10 мг/кг .
Ванадий и его соединения очень токсичны для водных организмов (окружающей среды).
Установлено, что ванадий может тормозить синтез жирных кислот , подавлять образование холестерина . Ванадий ингибирует ряд ферментных систем [ источник не указан 3026 дней ] , тормозит фосфорилирование и синтез АТФ , снижает уровень коферментов А и Q , стимулирует активность моноаминоксидазы и окислительное фосфорилирование.
Избыточное поступление ванадия в организм обычно связано с экологическими и производственными факторами. При остром воздействии токсических доз ванадия у рабочих отмечаются местные воспалительные реакции кожи и слизистых оболочек глаз, верхних дыхательных путей, скопление слизи в бронхах и альвеолах. Возникают и системные аллергические реакции типа астмы и экземы ; а также лейкопения и анемия , которые сопровождаются нарушениями основных биохимических параметров организма.
При введении ванадия животным (в дозах 25—50 мкг/кг) отмечается замедление роста, диарея и увеличение смертности.
Всего в организме среднего человека (масса тела 70 кг) 0,11 мг ванадия. Токсическая доза для человека 0,25 мг, летальная доза — 2—4 мг.
Повышенное содержание белков и хрома в рационе снижает токсическое действие ванадия. Нормы потребления для этого минерального вещества не установлены.
Кроме того, высокое содержание ванадия выявлено у некоторых морских беспозвоночных ( голотурий и асцидий ), у которых он входит в состав белковых комплексов плазмы и форменных элементов крови и целомической жидкости. В клетках крови асцидий массовая доля ванадия может доходить до 0,88 % . Функция элемента в организме до конца не ясна , разные учёные считают его отвечающим либо за перенос кислорода в организме этих животных, либо за перенос питательных веществ. С точки зрения практического использования — возможна добыча ванадия из этих организмов, экономическая окупаемость таких «морских плантаций» на данный момент не ясна, но в Японии имеются пробные варианты.
См. также
Примечания
- ↑ Meija J. et al. (англ.) // Pure and Applied Chemistry . — 2016. — Vol. 88 , no. 3 . — P. 265—291 . — doi : .
- ↑ Коршунов Б. Г. Ванадий // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц . — М. : Советская энциклопедия , 1988. — Т. 1: А — Дарзана. — С. 349. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8 .
- Pergament A., Khanin S. (рус.) . “Basic Research and Higher Education” and “Development of the Scientific Potential of Higher Education”, supported by the Ministry of Education and Science of the Russian Federation and the American Civil Research and Development Foundation (CRDF), grant No. RUX0-000013-PZ-06) (13 мая 2009). Дата обращения: 22 января 2022. 22 января 2022 года.
- Sefström, N. G. (нем.) // Annalen der Physik und Chemie : magazin. — 1831. — Bd. 97 , Nr. 1 . — S. 43—49 . — doi : . — . 3 мая 2019 года.
- Featherstonhaugh, George William. (неопр.) // The Monthly American Journal of Geology and Natural Science. — 1831. — С. 69 .
- (англ.) . — National Cotton Council of America, 1991.
- ↑ Rehder D. Bioinorganic Vanadium Chemistry (англ.) . — 1st ed. — Hamburg, Germany: John Wiley & Sons, Ltd , 2008. — P. 5 & 9—10. — (Inorganic Chemistry). — ISBN 9780470065099 . — doi : .
- Busch P. M. (англ.) . — U.S. Department of the Interior, Bureau of Mines, 1961.
- Wise, James M. (май 2018). Дата обращения: 17 ноября 2019. 10 сентября 2021 года.
- . Дата обращения: 19 сентября 2010. Архивировано из 5 апреля 2015 года.
- . www.kommersant.ru (15 февраля 2005). Дата обращения: 20 января 2022. 20 января 2022 года.
- Holleman A. F., Wiberg E., Wiberg N. Das Vanadium // Lehrbuch der Anorganischen Chemie (нем.) . — Walter de Gruyter , 1985. — S. 1071—1075. — ISBN 978-3-11-007511-3 . — doi : .
- ↑ Michibata H., Hirose H., Sugiyama K., Ookubo Y., Kanamori K. // Biological Bulletin. — 1990. — Vol. 179. — P. 140—147.
- Дата обращения: 31 января 2020. 31 января 2020 года.
- Langeslay R. R. et al. Catalytic Applications of Vanadium: A Mechanistic Perspective (англ.) // . — 2018. — Vol. 119 , iss. 4 . — doi : . — .
- Eriksen K. M., Karydis D. A., Boghosian S., Fehrmann R. Deactivation and Compound Formation in Sulfuric-Acid Catalysts and Model Systems (англ.) // . — 1995. — Vol. 155 , no. 1 . — P. 32—42 . — doi : .
- . Roskill . Roskill Information Services (5 марта 2019). Дата обращения: 19 апреля 2019. 19 апреля 2019 года.
- Титановые сплавы. Металлография титановых сплавов / Под ред. Н.Ф. Аношкина. — М. : Металлургия, 1980. — С. 11. — 464 с.
- . Дата обращения: 29 августа 2018. 29 августа 2018 года.
- Betz F. (англ.) . — Wiley-IEEE, 2003. — P. 158—159. — ISBN 978-0-471-22563-8 .
- . Дата обращения: 29 августа 2018. 29 августа 2018 года.
- . Дата обращения: 29 августа 2018. 29 августа 2018 года.
- Слотвинский-Сидак Н. П. // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц . — М. : Советская энциклопедия , 1988. — Т. 1: А — Дарзана. — С. 351—352. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8 .
- . Дата обращения: 13 апреля 2019. 1 мая 2019 года.
Ссылки
|
|
Некоторые
внешние ссылки
в этой статье
ведут на сайты, занесённые в
спам-лист
|
- 2020-02-09
- 2
