Организм
- 1 year ago
- 0
- 0
Конъюга́ция (от лат. conjugatio — соединение) — однонаправленный перенос части генетического материала ( плазмид или бактериальной хромосомы ) при непосредственном контакте двух бактериальных клеток. Открыт в 1946 году Джошуа Ледербергом и Эдвардом Татумом . Явление конъюгации было открыто и хорошо изучено у кишечной палочки ( Escherichia coli ), но в дальнейшем конъюгация была описана у множества как грамположительных , так и грамотрицательных бактерий . Посредством конъюгации бактерии обмениваются генетическим материалом, поддерживая своё генетическое разнообразие .
Существование конъюгации у бактерий было показано в 1946 году Джошуа Ледербергом и Эдвардом Татумом. Они смешали два штамма кишечной палочки Escherichia coli , ауксотрофных (неспособных существовать на среде без определённого вещества) по разным веществам, инкубировали полученную культуру несколько часов в среде, содержащей все необходимые питательные вещества , и высеяли клетки на чашки с минимальной средой. Чтобы избежать искажения данных эксперимента реверсией некоторых мутаций , отвечающих за ауксотрофию, они использовали двойные и тройные ауксотрофы. Благодаря этому возможность появления клеток , не ауксотрофных по всем трём соединениям, за счёт реверсии мутаций была крайне низка. Когда на чашках появились колонии , исследователи заключили, что бактерии обменялись генами , которые восстанавливали нормальный фенотип . Однако Ледерберг и Татум не доказали, что ДНК передавалась между бактериями при непосредственном физическом контакте. Это удалось сделать в 1950 году. Он сконструировал U-образную трубку, разделённую напополам перегородкой, через которую могла проходить среда, но не бактериальные клетки. Далее Дэвис инкубировал в трубке несколько ауксотрофных штаммов, сильно перемешивая среду. После высеивания клеток на минимальную среду колоний не появилось. Таким образом, было показано, что для обмена ДНК, открытого Ледербергом и Татумом, был необходим физический контакт двух клеток. Впоследствии конъюгацию описали и у других бактерий, в том числе грамположительных, таких как Bacillus subtilis . Однако наиболее изучена конъюгация у E. coli , механизм которой детально рассматривается ниже.
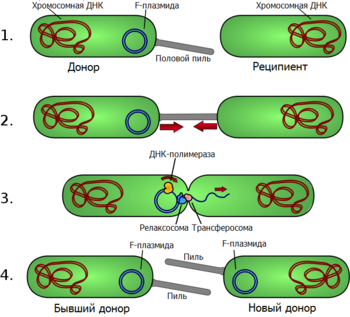
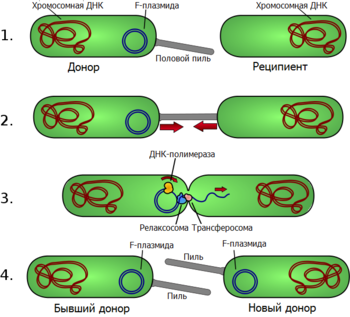
Под конъюгацией понимают перенос ДНК между бактериальными клетками при их непосредственном контакте. Как правило, при конъюгации передаются плазмиды , но у некоторых организмов передаваться может и хромосомная ДНК. При конъюгации имеет место однонаправленный перенос генетического материала от клетки-донора к клетке-реципиенту . Ниже рассматривается процесс конъюгации на примере E. coli , то есть у грамотрицательных бактерий; конъюгация у грамположительных бактерий рассматривается в разделе .
В подавляющем большинстве случаев конъюгация возможна лишь тогда, когда у донорской клетки есть плазмида, содержащая гены, обеспечивающие передачу ДНК. У E. coli и других грамотрицательных бактерий физический контакт между двумя клетками обеспечивается половыми пилями — полыми белковыми структурами на поверхности клеток. Структура половых пилей сильно варьирует: пили, кодируемые F-плазмидой , длинные, тонкие и гибкие, а пили, кодируемые плазмидой RP4, — короткие, толстые и жёсткие. Пили взаимодействуют с рецепторами на поверхности клетки-реципиента, за счёт чего конъюгирующие клетки образуют пару. Механизм образования пары клеток при конъюгации очень похож на работу бактериальной системы секреции IV типа, с помощью которой некоторые патогенные бактерии доставляют токсины непосредственно в клетку организма-хозяина .
Передача ДНК через контакт, образуемый пилем, начинается с того, что в специфическом участке передаваемой плазмиды, называемом ( oriT ), особый белок вносит одноцепочечный разрыв ( ). Хеликаза , кодируемая передаваемой плазмидой, расплетает плазмидную ДНК, и разрезанная цепь переносится в клетку-реципиент своим 5'-концом вперёд. Параллельно с этим её 3'-конец удлиняется, восполняя уходящую цепь в плазмиде-доноре по механизму репликации типа катящегося кольца . Одноцепочечная ДНК, перенесённая в клетку-реципиент, также достраивается до двуцепочечной. Таким образом, конъюгация является репликативным процессом и, строго говоря, передаётся не сама плазмида, а её копия .
К описанной выше передаче между клетками способны далеко не все плазмиды (их называют конъюгативными; например, таковой является F-плазмида E. coli ). Иногда конъюгативная плазмида способствует передаче клетке-реципиенту неконъюгативной плазмиды при помощи процесса, который носит название мобилизации. В качестве примера можно рассмотреть мобилизацию неконъюгативной плазмиды . Она содержит ген mob , кодирующий специфическую нуклеазу , и сайт bom (аналогичный oriT ), и белок Mob вносит одноцепочечный разрыв в плазмиду. По сути, для того, чтобы быть конъюгативной, плазмиде ColE1 недостаёт генов, которые кодировали бы аппарат переноса ДНК, поэтому она может передаваться в клетку-реципиент через аппарат передачи, кодируемый конъюгативной плазмидой. Иногда мобилизуемая плазмида может не иметь собственного гена mob , а одноцепочечный разрыв вносит в неё белок Mob близкородственной плазмиды .
В подавляющем большинстве случаев при конъюгации передаётся плазмидная ДНК. Однако у некоторых бактерий возможна передача и хромосомной ДНК. Например, фрагменты геномной ДНК могут передаваться вместе с F-плазмидой у E. coli , и похожие системы есть у других бактерий, например, Pseudomonas aeruginosa . В некоторых случаях для передачи хромосомной ДНК необходима интеграция плазмиды в геномную ДНК бактерии, так что, по сути, геномная ДНК передаётся в составе плазмиды. Однако известны случаи, когда хромосомная ДНК передаётся в свободном виде, вероятно, по механизму, аналогичному мобилизации неконъюгативных плазмид .
При передаче плазмиды в ходе конъюгации клетка-реципиент получает полную одноцепочечную версию плазмиды, однако хромосомная ДНК не передаётся целиком в силу того, что её полная передача потребовала бы значительного времени. Так, для переноса полной хромосомы у E. coli потребовалось бы 100 минут (в то время как для передачи плазмиды длиной 40 тысяч пар оснований (п. о.) требуется 1 минута). Фрагмент геномной ДНК, перенесённый в клетку-реципиент, может использоваться последней для рекомбинации .
В 1952 году показал, что передача ДНК, описанная Ледербергом и Татумом, была полярна. Иными словами, в передаче участвовали клетка-донор (F + от англ. fertility — «плодовитость») и клетка-реципиент (F - ). Оказалось, что клетки F + -штамма содержат так называемую F-плазмиду . F-плазмида может находиться в клетке в двух состояниях: в свободном или в интегрированном в геном (эписомном) .
При скрещивании F + -клеток и F - -клеток клетка-донор не утрачивает свой F + -статус, но F - -клетка при этом его приобретает. При таком скрещивании редко утрачивается ауксотрофия, поскольку клетка-реципиент получает лишь ДНК F-плазмиды без геномной ДНК .
Иная ситуация складывается, когда F - -клетка конъюгирует с клеткой, у которой F-плазмида встроилась в геном. Такие клетки с встроенной в геном F-плазмидой называются Hfr от англ. high frequency of recombination , поскольку при их передаче клетка-реципиент часто получает и фрагмент геномной ДНК, который использует для рекомбинации. При интеграции F-плазмиды в геном все гены, необходимые для переноса ДНК, такие как гены, кодирующие белки пилей, остаются функциональными. В начале конъюгации между Hfr -клетами и F - -клеткой в сайт oriT интегрированной F-плазмиды вносится одноцепочечный разрыв, и ДНК начинает переходить в клетку-реципиент, однако в неё сначала поступает лишь фрагмент F-хромосомы, а за ней — уже геномная ДНК. Как упоминалось выше, для переноса полного генома требуется около 100 минут, поэтому бактерии-партнёры разрывают контакт раньше, чем успеет перенестись вся геномная ДНК. Поскольку реципиент редко получает полную копию F-плазмиды, он остаётся F - -клеткой .
Поскольку интегрированная в геном F-плазмида представляет собой эписому, она может покинуть бактериальный геном и восстановить свой автономный статус. Однако иногда при вырезании хромосомы происходит ошибка, и она захватывает с собой небольшой фрагмент геномной ДНК. Такую плазмиду называют F'-плазмидой. Поскольку F'-плазмида по-прежнему содержит все гены, необходимые для конъюгации, она остаётся конъюгативной и может передаваться F - -клетке по механизму катящегося кольца. Однако по завершении конъюгации клетка-реципиент становится частично диплоидной ( мерозиготой ), потому что те участки генома, которые привнесла в неё F'-плазмида, содержатся в ней теперь в двойном комплекте. Конъюгацию, которую опосредует F'-плазмида, иногда называют сексдукцией. Стоит отметить, что между гомологичными участками на F'-плазмиде и хромосоме реципиента может происходить рекомбинация . Через F'-плазмиды бактериальные гены могут быстро распространяться в популяциях .
В процессе конъюгации задействовано множество белков. Одноцепочечный разрыв в области oriT и начальное расплетание цепей ДНК производит белковый комплекс, известный как релаксосома . У E. coli половой пиль, по сути, представляет собой систему секреции IV типа. Она состоит из множества копий белков Tra, в том числе TraA, которые формируют пиль, и TraD, которые обеспечивают процесс энергией за счёт гидролиза АТФ . Некоторые белки Tra находятся в клеточной мембране , некоторые продолжаются в периплазматическое пространство и проходят через слой пептидогликана , достигая внешней мембраны и её липополисахаридного слоя .
F-плазмида содержит особый регуляторный участок, в состав которого входит, в частности, ген traJ . Белок TraJ положительно регулирует экспрессию других генов tra , которые необходимы для образования и функционирования половых пилей. Антисмысловая РНК и FinO образуют комплекс FinOP, который репрессирует образование белка TraJ и, таким образом, является ингибитором конъюгации. Описаны ещё 5 систем ингибирования переноса F-плазмиды и F-подобных плазмид в клетку-реципиент. Среди таких систем finW локализована в F-подобной плазмиде R455, системы finQ, finU и finV выявлены в ряде не-F-подобных плазмид, а система finC находится в многокопийном мутанте неконъюгативной плазмиды CloDF13. Все эти системы так или иначе регулируют гены tra . Сама F-плазмида тоже может ингибировать перенос других плазмид: так, она подавляет перенос плазмиды RP4 в 500—1000 раз .
Гены клетки-хозяина также могут влиять на конъюгативный перенос плазмид. Например, в геноме штамма K-12 E. coli выявлены гены sfrA и sfrB , которые регулируют некоторые гены tra . Кроме того, мутации в геномном гене fex понижают конъюгативный потенциал F-плазмиды .
Клетка, содержащая в том или ином виде конъюгативную плазмиду, не может выступать в роли реципиента при конъюгации. Это явление получило название поверхностного исключения и впервые было описано у F-плазмиды, на которой лучше всего и изучено. Гены, которые отвечают за поверхностное исключение, обозначают Sfx. Такие гены были идентифицированы в F-плазмиде и нескольких F-подобных плазмидах, например, R100. Известно пять групп плазмид, различных по признаку поверхностного исключения. Представителями этих групп являются плазмиды F, ColB2-K98, R1, R100 и pED208 соответственно. Иногда ряд F-подобных плазмид выделяют в шестую группу по признаку Sfx. Однако, даже если плазмиды относятся к разным группам по признаку Sfx, нельзя безоговорочно говорить о поверхностном исключении и невозможности конъюгации. Показано, что в большинстве случаев поверхностная несовместимость связана с особенностями половых пилей .
Описанный выше механизм конъюгации относится к грамотрицательным бактериям. Вместе с тем к конъюгации способны многие грамположительные бактерии, от Streptomyces до Enterococcus . Во многих таких случаях механизм передачи ДНК принципиально схож с таковым у грамотрицательных бактерий. Однако в то время, как у грамотрицательных бактерий для конъюгации необходимы как минимум 20 генов, у грамположительных бактерий в конъюгации задействовано существенно меньше генов, иногда всего лишь пять. Поэтому конъюгативные плазмиды грамположительных бактерий зачастую мельче таковых у грамотрицательных. Кроме того, в силу особенностей строения клеточной стенки (толстый слой пептидогликана) в конъюгации у грамположительных бактерий не задействованы пили. Система конъюгации достаточно изучена у грамположительной бактерии . Некоторые штаммы этого вида секретируют растворимые феромоны пептидной природы, которые стимулируют экспрессию генов tra на конъюгативных плазмидах соседних клеток (любопытно, что в этом случае феромоны выделяют реципиенты генетического материала, а не наоборот, как это происходит обычно). У клеток-доноров, содержащих конъюгативную плазмиду, на поверхности находятся рецепторы к феромонам, причём разным плазмидам соответствуют разные феромоны и, соответственно, разные рецепторы. После связывания с рецептором феромон доставляется в цитоплазму специальным белком, и в цитоплазме феромон взаимодействует с белком TraA. В свободном виде этот белок подавляет экспрессию белков tra , а при связывании с феромоном утрачивает ингибиторные свойства, и экспрессия генов tra активируется. В результате образуется сложная , соединяющая клетку-донора и реципиента .
У E. faecalis возможна конъюгация, опосредованная не плазмидами, а транспозоном — Tn 916 . Он содержит сайт oriT , похожий на таковой у плазмид. В начале конъюгации Tn 916 вырезается из бактериальной хромосомы двумя ферментами , которые сам и кодирует, — Int и Xis, которые родственны ферментам, обеспечивающим вырезание бактериофага λ . Далее он принимает кольцевую форму и становится похож на конъюгативную плазмиду, так как содержит oriT и гены tra . При этом даже в кольцевой форме Tn 916 не имеет ориджина репликации , а потому неспособен к удвоению. Механизм переноса ДНК в случае Tn 916 аналогичен таковому для конъюгативных плазмид. Когда в клетке-реципиенте образуется двуцепочечная кольцевая форма транспозона, фермент интеграза вставляет его в случайный участок бактериального генома. Tn 916 является прототипом группы родственных конъюгативных транспозонов у грамположительных кокков , хотя конъюгативные транспозоны описаны и у грамотрицательных бактерий. Наряду с плазмидами, конъюгативные транспозоны тоже могут вносить свой вклад в распространение устойчивости к антибиотикам : так, Tn 916 содержит ген устойчивости к тетрациклину .
После открытия штаммов Hfr Элли Вольман и Франсуа Жакоб предложили новый метод картирования бактериальной хромосомы — метод прерывания скрещивания. Они смешивали в одной культуре F + и F - клетки, несущие определённые хромосомные маркеры, инкубировали их некоторое время, потом путём резкого встряхивания, разрушающего контакты между клетками, прерывали конъюгацию и отбирали клетки, в которых произошла рекомбинация. Прерывая конъюгацию в разные временные промежутки и определяя, какие гены и на какой минуте после начала конъюгации передавались, можно установить порядок расположения генов, то есть картировать их на бактериальной хромосоме .