Спирты
- 1 year ago
- 0
- 0

Этано́л (эти́ловый спи́рт, эти́лгидрат, мети́лкарбино́л, ви́нный спи́рт или алкого́ль, в просторечии — «спи́рт», химическая формула — C 2 H 6 O , или C 2 H 5 OH , или CH 3 CH 2 OH ) — органическое соединение , относящееся к классу одноатомных спиртов .
При стандартных условиях , этанол — это летучая, горючая, бесцветная прозрачная жидкость с характерным запахом и жгучим вкусом.
Действующий компонент алкогольных напитков . Является депрессантом — психоактивным веществом , угнетающим центральную нервную систему человека .
В обычных условиях представляет собой бесцветную, легкоподвижную, летучую жидкость с характерным запахом и жгучим вкусом.
Плотность этилового спирта 0,789 г/см 3 при 20 °C , он легче воды .
Является хорошим растворителем многих органических веществ и некоторых неорганических солей.
Физические свойства абсолютированного этанола ( 100 % ) немного отличаются от свойств спирта-ректификата с концентрацией 95,57 % . Их свойства почти одинаковы, но численные величины различаются на 0,1—0,01 % .
| Молекулярная масса | 46,069 а. е. м. |
| Температура замерзания | −114,15 °C |
| Температура кипения | 78,39 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | Смешивается в произвольных отношениях с бензолом , водой, глицерином , диэтиловым эфиром , ацетоном , метанолом , уксусной кислотой , хлороформом |
| Показатель преломления | Показатель преломления (для D-линии натрия) 1,3611 (при 20 °C) (температурный коэффициент показателя преломления −4,0⋅10 −4 /°C, почти постоянный в интервале температур 10—30 °C ) |
| Стандартная энтальпия образования Δ H | −234,8 кДж/моль (г) (при 298 К) |
| S | 281,38 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость C p | 1,197 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления Δ H плав | 4,81 кДж/моль |
| Энтальпия кипения Δ H кип | 839,3 кДж/моль |
|
|
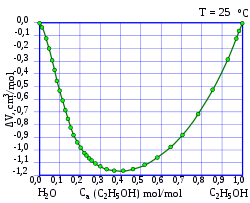
Смесь по массе 95,57 % этанола и 4,43 % воды является азеотропной , т. е. не разделяется при перегонке , при нормальном давлении температура кипения составляет 78,174 °C, в то время как абсолютированный этанол имеет более высокую точку кипения в 78,39 °C .
С водой этанол смешивается в произвольном отношении, при смешивании наблюдается значительное, до нескольких процентов уменьшение объёма смеси относительно исходного суммарного объёма чистых веществ, например, при смешивании 50 мл этанола с 50 мл воды образуется 97 мл раствора. Также смешивание сопровождается некоторым нагреванием смеси.
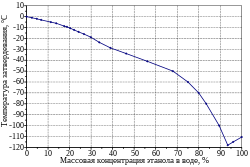
Абсолютный этанол затвердевает при температуре −114,5 °C . Температура плавления смесей этанола с водой уменьшается при увеличении концентрации этанола в растворе и достигает минимума при массовой концентрации этанола в воде равной 93,5 % — эвтектики этанол-вода, имеющей температуру плавления −118 °C . При низких температурах, ниже −20 °С водный раствор этанола (96 %) практически не испаряется и превращается в вязкую жидкость. При −70°C он становится ещё более вязким и по текучести напоминает густой мёд.
| t | 10°С | 20°С | 30°С | 40°С | 50°С | 60°С | 70°С | 80°С | 90°С | 100°С | 110°С | 120°С | 130°С | 140°С |
| P, мм рт.ст. | 23,6 | 43,9 | 79,2 | 135,3 | 222,2 | 352,7 | 543,6 | 809,7 | 1170,4 | 1651,5 | 2280,2 | 3087,5 | 4107,9 | 5380,2 |
| P, 10 5 Па | 0,0315 | 0,0585 | 0,1056 | 0,1804 | 0,2962 | 0,4702 | 0,7247 | 1,0795 | 1,5604 | 2,2018 | 3,04 | 4,1163 | 5,4767 | 7,173 |
| P, атм | 0,0311 | 0,0578 | 0,1042 | 0,1780 | 0,2924 | 0,4641 | 0,7153 | 1,0654 | 1,5400 | 2,1730 | 3,0003 | 4,0625 | 5,4051 | 7,0792 |
lg p [kPa] = 7,81158 − 1918,508 / (252,125 + t[°C]) при температуре от −31 до 78 °С
Типичный представитель одноатомных спиртов.
Горюч. Легко воспламеняется. При достаточном доступе воздуха горит (за счёт его кислорода ) светлым голубоватым пламенем, образуя конечные продукты окисления — диоксид углерода и воду :
Ещё энергичнее данная реакция протекает в атмосфере чистого кислорода .
При определённых условиях (температура, давление, катализаторы ) возможно и контролируемое окисление (как элементарным кислородом, так и многими другими окислителями) до ацетальдегида , уксусной кислоты , щавелевой кислоты и некоторых других продуктов, например:
Обладает слабо выраженными кислотными свойствами, в частности, подобно кислотам взаимодействует со щелочными металлами , а также магнием , алюминием и их гидридами , выделяя при этом водород и образуя солеподобные этилаты, являющиеся типичными представителями алкоголятов :
Обратимо реагирует с карбоновыми и некоторыми неорганическими кислородсодержащими кислотами с образованием сложных эфиров :
С галогеноводородами ( HCl , HBr , HI ) вступает в обратимые реакции нуклеофильного замещения :
Без катализаторов реакция с HCl идёт относительно медленно; значительно быстрее — в присутствии хлорида цинка и некоторых других кислот Льюиса .
Вместо галогеноводородов для замещения гидроксильной группы на галоген могут быть использованы галогениды и галогеноксиды фосфора, тионилхлорид и некоторые другие реагенты, например:
Сам этанол также обладает нуклеофильными свойствами. В частности, он относительно легко присоединяется по активированным кратным связям, например:
Реагирует с альдегидами с образованием полуацеталей и ацеталей :
При умеренном (не выше 120 °C ) нагревании с концентрированной серной кислотой или другими водоотнимающими средствами кислотного характера образует диэтиловый эфир :
При более сильном нагревании с серной кислотой , а также при пропускании паров над нагретым до 350—500°C оксидом алюминия происходит более глубокая дегидратация . При этом образуется этилен :
При использовании катализаторов, содержащих наряду с оксидом алюминия высокодисперсное серебро и другие компоненты, процесс дегидратации может быть совмещён с контролируемым окислением этилена элементным кислородом, в результате чего с удовлетворительным выходом удаётся реализовать одностадийный процесс получения окиси этилена :
В присутствии катализатора, содержащего оксиды алюминия , кремния , цинка и магния , претерпевает серию сложных превращений с образованием в качестве основного продукта бутадиена (реакция С. В. Лебедева ):
В 1932 году на основе этой реакции в СССР было организовано первое в мире крупнотоннажное производство синтетического каучука .
В слабощелочной среде образует иодоформ :
Эта реакция имеет некоторое значение для качественного и количественного определения этанола в отсутствие других веществ, дающих подобную реакцию.
Легковоспламеняющаяся бесцветная жидкость; удельная теплота сгорания — 30 МДж/кг , давление насыщенного пара, кПа: lg p [kPa] = 7,81158 − 1918,508 / (252,125 + t[°C]) при температуре от −31 до 78 °С; теплота сгорания — 1408 кДж/моль; теплота образования −239,4 кДж/моль; температура вспышки 13 °С (в закрытом тигле), 16 °С (в открытом тигле); температура воспламенения 18 °С; температура самовоспламенения 400 °С; концентрационные пределы распространения пламени 3,6—17,7 % по объёму; температурные пределы распространения пламени: нижний 11 °С, верхний 41 °С; минимальная флегматизирующая концентрация, % объёмных: CO 2 — 29,5, H 2 O — 35,7, N 2 — 46; максимальное давление взрыва 682 кПа; максимальная скорость нарастания давления 15,8 МПа/с; скорость выгорания 0,037 кг/(м 2 ·с); максимальная нормальная скорость распространения пламени — 0,556 м/с; минимальная энергия зажигания — 0,246 МДж; минимальное взрывоопасное содержание кислорода 11,1 % объёмных.
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение ) и синтетический ( гидратация этилена ).
Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы ( виноград , плоды и т. п. ) под действием ферментов дрожжей и бактерий . Аналогично выглядит переработка крахмала картофеля , риса , кукурузы . Источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её результат можно выразить уравнением:
Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путём дистилляции .
Для получения этанола данным способом наиболее часто используют различные штаммы дрожжей вида Saccharomyces cerevisiae , в качестве питательной среды предварительно обработанные древесные опилки и/или раствор, полученный из них.
Современная промышленная технология получения этилового спирта из пищевого сырья включает следующие стадии:
Отходами бродильного производства являются углекислый газ , барда , эфиро-альдегидная фракция, сивушный спирт и сивушные масла .
Спирт, поступающий из брагоректификационной установки (БРУ), не является безводным, содержание этанола в нём не более 95,6 %. В зависимости от содержания в нём посторонних примесей, его разделяют на следующие категории:
Производительность современного спиртового завода составляет около 30 000—100 000 литров спирта в сутки.
В промышленных масштабах этиловый спирт получают из сырья, содержащего целлюлозу ( древесина , солома ), которую предварительно гидролизуют . Образовавшуюся при этом смесь пентоз и гексоз подвергают спиртовому брожению. В странах Западной Европы и Америки эта технология не получила распространения, но в СССР (ныне в России ) существовала развитая промышленность кормовых гидролизных дрожжей и гидролизного этанола.
В промышленности, наряду с первым способом, используют гидратацию этилена . Гидратацию проводят по двум схемам:
Эта реакция сопровождается параллельной нежелательной реакцией образования диэтилового эфира .
Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95,6 % (мас.) ; эта неразделимая перегонкой азеотропная смесь содержит 4,4 % воды (мас.) и имеет температуру кипения 78,15 °C .
Перегонка освобождает этанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт — этиловый спирт, практически не содержащий воды. Он кипит при температуре 78,39 °C , в то время как спирт-ректификат, содержащий не менее 4,43 % воды, кипит при 78,15 °C . Получают перегонкой водного спирта, содержащего бензол , и другими способами , например, спирт обрабатывают веществами, реагирующими с водой или поглощающими воду, такими, как негашёная известь CaO или прокалённый медный купорос CuSO 4 .
Этанол используется как топливо , в качестве растворителя , как сырье в химической промышленности, в медицине — как дезинфицирующее средство и др.
Первым использовал этанол в качестве моторного топлива Генри Форд , который в 1880 году создал первый автомобиль, работающий на этаноле. Возможность использования спиртов в качестве моторного топлива была показана также в 1902 году, когда на конкурсе в Париже были выставлены более 70 карбюраторных двигателей, работающих на этаноле и смесях этанола с бензином . Этанол характеризуется высоким октановым числом , что делает его пригодным для бензиновых двигателей с высокой степенью сжатия .
Этанол может использоваться как топливо , в т. ч. для ракетных двигателей (так, этанол использовался в качестве топлива в первой в мире серийной баллистической ракете — немецкой « Фау-2 » и ранних советских ракетах конструкции Королёва — от Р-1 до Р-5 ), двигателей внутреннего сгорания, бытовых, походных и лабораторных нагревательных приборов (т. н. «спиртовок»), грелок для туристов и военнослужащих (каталитическое автоокисление на платиновом катализаторе). Ограниченно (в силу своей гигроскопичности ) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов — этил-трет-бутилового эфира , более независимого от ископаемой органики, чем МТБЭ .

Является универсальным растворителем различных веществ и основным компонентом духов , одеколонов , аэрозолей и т. п. Входит в состав разнообразных средств, включая зубные пасты, шампуни, средства для душа, и т. д.
Наряду с водой, является основным компонентом спиртных напитков ( водка , вино , джин , пиво и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным ( кефир , квас , кумыс , безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно ( 0,12 % ), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1—3 % этанола (в крепком до 4,5 % ), в квасе — от 0,5 до 1,2 % .
Растворитель для пищевых ароматизаторов . Может быть использован как консервант для хлебобулочных изделий, а также в .
Зарегистрирован в качестве пищевой добавки E1510 .
Энергетическая ценность этанола — 7,1 ккал/г.
Применяется для фиксирования и консервирования биологических препаратов. Используется для удаления пятен, например, древесной смолы . Благодаря низкой температуре замерзания водных растворов, может использоваться как теплоноситель в системах охлаждения.
Топливный этанол делится на биоэтанол и этанол, полученный другими методами (из отходов пластмасс , синтезированный из газа и т. п.).
Биоэтанол — это жидкое этанолсодержащее топливо , получаемое специальными заводами из крахмал -, целлюлозно - или сахаросодержащего сырья по укороченной дистилляции (что позволяет получать качество, достаточное для использования в качестве топлива). Содержит наряду с этанолом метанол и сивушные масла , что делает его совершенно непригодным для питья .
Применяется в чистом виде (точнее в виде азеотропа 96,6 %) , а чаще в смеси с бензином (так называемый газохол ) или дизельным топливом .
Производство и использование биоэтанола увеличивается в большинстве стран мира, как более экологичная и возобновляемая альтернатива нефти (недоступная ссылка) .
Полноценно использовать биоэтанол способны лишь автомобили с соответствующим двигателем или с универсальным Flex-Fuel (способен применять смеси бензин/этанол с любым соотношением). Обычный бензиновый двигатель способен потреблять бензин с добавкой этанола не более 30 % , возможно также переоборудование обычного бензинового двигателя, но это экономически нецелесообразно.
Некоторой проблемой является недостаточная смешиваемость бензина и дизельного топлива с этанолом, из-за чего происходит расслоение смеси (при низких температурах всегда). Особенно эта проблема актуальна для стран с холодным климатом. Решения этой проблемы на данный момент не найдено .
Преимуществом смесей этанола с другими видами топлива перед чистым этанолом является лучшая зажигаемость, благодаря низкому содержанию влаги, тогда как чистый этанол (марка E100, с практическим содержанием C 2 H 5 OH 96,6 % ) является неразделяемым дистилляцией азеотропом . Разделение же иными способами невыгодно. При добавлении этанола к бензину или дизельному топливу происходит отслаивание воды.
В разных странах действуют следующие государственные программы применения этанола и содержащих его смесей на транспорте с двигателями внутреннего сгорания :
|
|
|
|---|---|
| Бразилия | 22—25 % этанола в бензине, 2 % в дизельном топливе , доступны высокоэтанольные марки (E85, E100), их процент на рынке плавно увеличивают. Основной источник — сахарный тростник . Около 25-30 % мирового производства топливного спирта. |
| США | Внедряются марки смеси этанола и бензина (E85, E10). Предполагается ввести 20 % к 2020 году [ уточнить ] . Около 55—60 % мирового производства топливного спирта. |
| Венесуэла | 10 % этанола в бензине. |
| Евросоюз | До ~6 % добавляется в обязательном порядке, внедряются этанольные марки E10 и выше . |
| Аргентина | Обязательна 5 % добавка этанола в любых марках бензина, внедряются марки с большим содержанием. |
| Таиланд | 5 % этанола является минимальным допустимым содержанием в бензине. |
| Украина | Законодательно установлено содержание 5 % этанола в бензине с 2013, и 7 % с 2014 года. На заправках широко продается топливо с содержанием биоэтанола от 30 до 37,2 % |
| Колумбия | 10%-я смесь в больших городах к сентябрю 2005 года . |
| Канада | 5%-я смесь с 2010 года |
| Япония | Разрешено 3%-е содержание этанола в бензине и менее . |
| Индия | Была заявлена цель в 20 % биотоплив к 2017 году . Сейчас [ когда? ] 5 % [ уточнить ] . Производится из самого различного сырья, в частности из древесной стружки. |
| Австралия | Этанола в бензине не более 10 %, марка E10. |
| Индонезия | 10 % спирта в бензине. |
| Филиппины | E10 постепенно внедряется. |
| Ирландия | Марки E5—E10 достаточно широко применяются и продолжат внедряться. |
| Дания | Аналогично Ирландии. |
| Чили | Разрешено 2 % содержание этанола в автомобильном топливе. |
| Мексика | 3,2 % биотоплива в автомобильном топливе, обязательно с 2012 года . В Америке самая неохотно внедряющая биотопливо страна. |
Внедрение производства биотоплива является затратным процессом, однако дает экономике преимущества впоследствии. Так, например, строительство завода по производству этанола мощностью 40 млн галлонов даёт экономике (на примере США ):
В 2006 году этаноловая индустрия дала экономике США :
В 2006 году в США было переработано в этанол 2,15 миллиарда бушелей [ что? ] [ уточнить ] кукурузы , что составляет 20,5 % годового производства кукурузы . Этанол стал третьим по величине потребителем кукурузы после животноводства и экспорта. На этанол перерабатывается 15 % урожая сорго США . Побочным продуктом производства этанола является барда , которая используется как вторичное кормовое сырьё , а также может быть использована для получения биогаза .
В США «Энергетический билль», подписанный президентом Бушем в 2005 году, предусматривал производство к 2012 году ежегодно 30 миллиардов литров этанола из зерна и 3,8 млрд литров из целлюлозы (стебли кукурузы , рисовая солома, отходы лесной промышленности) .
Производство этанола на топливо по странам, млн литров. Данные по ежегодным отчетам от 17 мая 2008 на Wayback Machine .
| Страна | 2004 | 2009 | 2014 | 2019 |
|---|---|---|---|---|
| США | 13 381 | 40 125 | 54 131 | 59 809 |
| Бразилия | 15 100 | 24 900 | 23 432 | 32 630 |
| Евросоюз | 3 935 | 5 470 | 5 451 | |
| Китай | 3 649 | 2 050 | 2 404 | 3 407 |
| Индия | 1 749 | 347 | 587 | 2 006 |
| Канада | 231 | 1 100 | 1 931 | 1 893 |
| Таиланд | 280 | 1 647 | 1 173 | 1 590 |
| Аргентина | 159 | — | 606 | 1 098 |
| Россия | 750 | 517 [ источник не указан 1103 дня ] | — | — |
| ЮАР | 416 | — | — | — |
| Франция | 829 | |||
| Великобритания | 401 | |||
| Весь мир | 40 769 | 73 948 | 93 008 | 110 155 |
Смесь этанола с бензином обозначается буквой Е. Цифрой у буквы Е обозначается процентное содержание этанола. Е85 означает смесь из 85 % этанола и 15 % бензина.
Смеси до 20 % содержания этанола могут применяться на любом автомобиле . Однако некоторые производители автомобилей ограничивают гарантию при использовании смеси с содержанием более 10 % этанола. Смеси, содержащие более 20 % этанола, во многих случаях требуют внесения изменения в систему зажигания автомобиля .
Автопроизводители выпускают автомобили, способные работать и на бензине, и на Е85. Такие автомобили называются « Flex-Fuel ». В Бразилии такие автомобили называют «гибридными». В русском языке названия нет. Большинство современных автомобилей либо изначально поддерживает использование такого топлива, либо опционально, по соответствующему запросу.
В 2005 году в США более 5 млн автомобилей имели гибридные двигатели. В конце 2006 года в США эксплуатировалось 6 млн автомобилей с такими двигателями. Общий автопарк составляет 230 млн автомобилей.
1200 заправочных станций продают Е85 (май 2007 ). Всего в США автомобильное топливо продают около 170 000 заправочных станций.
В Бразилии около 29 000 заправочных станций продают этанол.
Себестоимость бразильского этанола (около 0,19 долларов США за литр в 2006 году) делает его использование экономически выгодным от 15 июля 2014 на Wayback Machine .
Биоэтанол как топливо часто называют «нейтральным» в качестве источника парниковых газов . Он обладает нулевым балансом диоксида углерода , поскольку при его производстве путём брожения и последующем сгорании выделяется столько же CO 2 , сколько до этого было взято из атмосферы использованными для его производства растениями . Однако ректификация этанола требует дополнительных затрат энергии, вырабатываемой одним из «традиционных» способов (в том числе и сжиганием ископаемого топлива ).
В 2006 году применение этанола в США позволило сократить выбросы около 8 млн тонн парниковых газов (в СО 2 эквиваленте), что примерно равно годовым выхлопам 1,21 млн автомобилей .

В биохимии этанола существенную роль играет тот факт, что он образует растворы в широком диапазоне пропорций как с водой, так и с жирами. Является побочным продуктом метаболизма глюкозы , в крови здорового человека может содержаться до 0,01 % эндогенного этанола, являющегося продуктом метаболизма .
При приёме внутрь этанол обладает наркотическим и токсическим действием , в зависимости от дозы, концентрации, пути попадания в организм и длительности воздействия его действие различается . Любая доза алкоголя приносит вред организму, безопасной его дозы не существует .
Под наркотическим действием обозначается его способность вызывать кому, ступор , нечувствительность к боли , угнетение функций ЦНС, алкогольное возбуждение , привыкание , а также его наркозное действие . Под действием этанола происходит выделение эндорфинов в прилежащем ядре (Nucleus accumbens), у страдающих алкоголизмом — также в орбитофронтальной коре (поле 10) . Тем не менее с юридической точки зрения этиловый спирт наркотиком не признан, так как это вещество не включено в международный список контролируемых веществ конвенции ООН 1988 года . В определённых дозах к массе тела и концентрациях приводит к острому отравлению и смерти.
Основной метаболит этанола ацетальдегид является токсичным, мутагенным и, возможно, канцерогенным веществом . Существуют доказательства канцерогенности ацетальдегида в экспериментах на животных; кроме того, ацетальдегид повреждает ДНК .
Длительное употребление этанола может вызвать такие заболевания, как цирроз печени , гастрит , некротизирующий панкреатит , язва желудка , рак груди , рак желудка и рак пищевода (то есть является канцерогеном ), гемолитическая анемия , артериальная гипертензия , инсульт , стать причиной внезапной смерти людей, страдающих ишемической болезнью сердца :159 ; может вызвать серьёзные нарушения обмена веществ :157 . Алкоголь может увеличить риск рождения ребёнка с врождёнными аномалиями нервной системы и обусловить задержку роста .
Употребление этанола может вызвать оксидативное повреждение нейронов головного мозга , а также их гибель вследствие повреждения гемато-энцефалического барьера .
Злоупотребление алкогольными напитками может привести к клинической депрессии и алкоголизму .
Приём алкогольных напитков на фоне приёма лекарств очень нежелателен, так как алкоголь извращает действие лекарственных средств и вследствие этого становится опасен для жизни человека. Отрицательное влияние алкогольных напитков на результаты фармакотерапии многообразно и зависит от различных факторов: индивидуальных свойств больного, его чувствительности, тяжести заболевания, но во всех случаях у пациентов, принимающих лекарства и потребляющих алкоголь, эффективность фармакотерапии ослабляется, а порой и сводится на нет :157,159 .
Этанол может в небольших количествах синтезироваться в просвете желудочно-кишечного тракта в результате процессов ферментации углеводной пищи микроорганизмами (условный эндогенный алкоголь) . Существование биохимических реакций с синтезом этанола в тканях организма человека (истинно эндогенный алкоголь) полагается возможным, но не доказано к настоящему моменту . Количество эндогенного алкоголя редко превышает 0,18 промилле , что находится на границе чувствительности самых современных приборов. Обычный алкотестер такое количество определить не может .
Этанол может наносить вред здоровью и при вдыхании паров при достаточно большой концентрации. В РФ установлена ПДК этого вещества: 1000 мг/м 3 (среднесменная, за 8 часов) и 2000 мг/м 3 (максимальная разовая). По классу опасности этиловый спирт отнесён к 4-му классу опасности (малоопасное вещество).
Для обозначения данного вещества используется несколько наименований. Технически наиболее правильным является термин этанол или этиловый спирт . Однако значительное распространение получили названия алкоголь , винный спирт или просто спирт , хотя спирты, или алкоголи — это более широкий класс веществ.
Названия этанол и этиловый спирт указывают на то, что данное соединение содержит в своей основе этил — радикал этана . При этом слово спирт (суффикс -ол ) в названии указывает на содержание гидроксильной группы (-OH) , характерной для спиртов .
Название алкоголь происходит от араб. الكحل аль-кухуль , означающего мелкий порошок, полученный возгонкой , порошкообразная сурьма , порошок для подкрашивания век . В средневековой латыни словом лат. alcohol обозначали порошки, дистиллированную воду .
В русский язык слово «алкоголь» пришло через его немецкий вариант нем. Alkohol . Однако в русском языке сохранился в виде архаизма , по всей видимости, и омоним слова «алкоголь» в значении «мелкий порошок» .
Наименование этанола винный спирт произошло от лат. spiritus vini (дух вина). В русский язык слово «спирт» пришло через английский его вариант англ. spirit .
В английском языке слово «спирт» в данном значении использовалось уже в середине XIII века, и только начиная с 1610 года слово «спирт» стало употребляться алхимиками для обозначения летучих веществ, что соответствует основному значению слова «spiritus» (испарения) в латинском языке . К 1670-м годам значение слова сузилось до «жидкостей с высоким процентным содержанием алкоголя» , а летучие жидкости получили название эфиров .
См. также Этимология названия в статье «Спирты» .