Этаноламин
- 1 year ago
- 0
- 0

Этано̀лами́н HO-CH 2 CH 2 -NH 2 (глицинóл, 2-аминоэтанóл, тривиальное название коламин) — органическое вещество класса аминоспиртов , является первичным амином и первичным спиртом. Также называется моноэтаноламином для отличия от диэтаноламина (NH(CH 2 CH 2 OH) 2 ) и триэтаноламина (N(CH 2 CH 2 OH) 3 ).
Вязкая маслянистая жидкость с температурой кипения 170 °C. Имеет слабый аминный запах. Смешивается с водой во всех отношениях. Хорошо растворим в этаноле , бензоле , хлороформе .
В промышленности синтез этаноламина проводится присоединением аммиака к этиленоксиду в присутствии небольшого количества воды. Процесс осуществляют в одну стадию при температуре 90—130 °С и давлении 7—10 МПа.

Наряду с моноэтаноламином при этом получаются диэтаноламин и триэтаноламин . При соотношении этиленоксид/аммиак (1:15) в продуктах реакции содержится 78,3 % моно-, 16 % ди- и 4,4 % триэтаноламинов. Этиленоксид в реакции реагирует нацело.
Соотношение этаноламинов в смеси регулируют концентрацией NH 3 , температурой процесса и повторным направлением в реакцию одного или двух этаноламинов.
Образующуюся смесь этаноламинов, Н 2 О и NH 3 разделяют ректификацией , при этом аммиак в сжиженном виде повторно направляют в реактор.
В лаборатории этаноламин получают действием аммиака на этиленхлоргидрин (2-хлорэтанол):
Этаноламин — слабое основание (pK a =9.50). С минеральными и сильными органическими кислотами образует соли.
При взаимодействии со сложными эфирами и карбоновыми кислотами или их ангидридами и хлорангидридами моноэтаноламин превращается в соответствующие N-(2-гидрооксиэтил)амиды кислот:
Моноэтаноламин с альдегидами (за исключением формальдегида ) и кетонами даёт основания Шиффа , последние обычно находятся в равновесии с изомерными оксазолидинами:

При взаимодействии солей моноэтаноламина с KCN или NaCN и альдегидами и кетонами образуются N-(гидроксиэтил)аминонитрилы:
Моноэтаноламин при реакции с CS 2 образует N -(2-гидроксиэтил)дитиокарбаминовую кислоту, которая при нагревании даёт меркаптотиазолин:

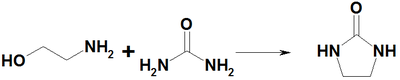
При нагревании с мочевиной образуется этиленмочевина:
С γ -бутиролактоном — N -(2-гидроксиэтил)пирролидон, который далее превращается в N-винилпирролидон:

Аммонолиз моноэтаноламина в присутствии Н 2 и катализаторов гидрирования ( Ni или Cu ) приводит к образованию этилендиамину :
Этаноламин всегда присутствует в незначительном количестве в организме человека и животных при полноценном белковом питании. В организме он образуется при декарбоксилировании аминокислоты серина . Дальнейшие пути превращений связаны либо с синтезом одного из фосфатидов — кефалина , являющегося фосфатидилэтаноламином, либо с превращением этаноламина в холин .
Водные растворы этаноламина обладают щелочной реакцией и хорошо поглощают кислые газы ( диоксид углерода , диоксид серы , сероводород , а также газообразные и летучие тиолы ). При нагреве раствора поглощённые газы выделяются, регенерированный раствор повторно направляют для поглощения. Благодаря обратимости растворы этаноламина широко используются в качестве абсорбента в различных процессах газоочистки (например, удаление примесей сероводорода, углекислого газа и тиолов в нефтегазовой и нефтехимической промышленности) и для разделения газов (в частности, абсорбция углекислого газа из смеси газов при производстве водорода конверсией метана ).
Применяется в средствах для окраски волос в качестве заменителя раствора аммиака.
Этаноламин также является исходным веществом в промышленном синтезе таурина .
Моноэтаноламин обладает общетоксическим действием. В соответствии с ГОСТ 12.1.005-76 моноэтаноламин отнесён к токсичным высокоопасным химическим веществам по степени воздействия на организм, 2-го класса опасности . В высоких концентрациях может раздражать кожу и слизистые оболочки . Летальная доза ( ЛД 50 100-149 мг/кг (для белых мышей, перорально).
При остром отравлении возникает раздражение слизистых оболочек, урежение дыхания, двигательное возбуждение, судороги . У белых крыс, вдыхавших воздух с концентрацией моноэтаноламина 0,2—0,4 мг/л по 5 часов ежедневно в течение 6 месяцев наблюдались изменения функционального состояния центральной нервной системы и функций печени, незначительная анемия и ретикулоцитоз , повышенный диурез и белок в моче.
Крысы, подвергавшиеся практически непрерывному отравлению в течение 30 суток при концентрации 0,164 мг/л, погибали через 14—24 суток, но выживали в тех же условиях в течение 90 дней при концентрации 0,029 мг/л. Морские свинки при непрерывном вдыхании 0,184 мг/л погибали между 10 и 28 днём. Концентрация 0,037 мг/л переносилась в течение 90 суток, а 0,12 мг/л вызывала лишь слабые признаки отравления. Собаки пережили в течение 30 дней вдыхание 0,25 мг/л и 0,015 мг/л в течение 60 дней .
Санитарная норма по ПДК в воздухе рабочей зоны - 1 мг/м 3 (рекомендуемая) .