Броми́д алюми́ния
(
бромистый алюминий
) — это
неорганическое
бинарное соединение
. Химическая формула
 . Вещество представляет собой соль
алюминия
и
бромоводородной кислоты
. В твердом и жидком состоянии существует в форме
димера
: Al
2
Br
6
.
. Вещество представляет собой соль
алюминия
и
бромоводородной кислоты
. В твердом и жидком состоянии существует в форме
димера
: Al
2
Br
6
.
Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме
димера
Al
2
Br
6
, частично диссоциирующего в AlBr
3
, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al
2
Br
6
, Al
4
Br
12
, Al
6
Br
18
соответственно.
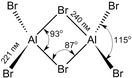
Структура молекулы бромида алюминия Al
2
Br
6
представляет собой сдвоенные
тетраэдры
, в центре которых расположены атомы алюминия,
ковалентно
связанные с атомами
брома
.
Координационное число
алюминия в молекуле бромида равно 4
.
Энергия разрыва связи Al—Br
в молекуле бромида алюминия составляет примерно 358 кДж/моль
.
Вещество очень
гигроскопично
: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr
3
•6H
2
O
. Хорошо растворимо в воде,
спирте
,
сероуглероде
,
ацетоне
; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор). Разлагается в горячей воде
.
Химические свойства
-
Безводный бромид алюминия очень энергично реагирует с водой, выделяя при растворении много тепла и частично
гидролизуясь
:
-
![{\displaystyle {\mathsf {AlBr_{3}+4H_{2}O\leftrightarrows [Al(H_{2}O)_{4}]^{3+}+3Br^{-}}}}](/images/005/352/5352071/11.jpg?rand=843361)
-
![{\mathsf {[Al(H_{2}O)_{4}]^{{3+}}+H_{2}O\leftrightarrows [Al(H_{2}O)_{3}(OH)]^{{2+}}+H_{3}O^{+}}}](/images/005/352/5352071/12.jpg?rand=246925)
-
При нагревании водного раствора гидролиз можно провести полностью:
-

-

-
![{\displaystyle {\mathsf {AlBr_{3}+4NaOH=Na[Al(OH)_{4}]+3NaBr}}}](/images/005/352/5352071/15.jpg?rand=559334)
-
При пропускании безводного
сероводорода
через раствор бромида алюминия в
сероуглероде
выпадает осадок комплексного соединения
:
-

-
При высокой температуре разлагается:
-

-
При нагревании бромида алюминия с
алюминием
в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия
:
-

-
![{\displaystyle {\mathsf {AlBr_{3}+4LiH=Li[AlH_{4}]+3LiBr}}}](/images/005/352/5352071/19.jpg?rand=127061)
-
Бромид алюминия — сильный акцептор
электронных пар
(
кислота Льюиса
) — легко присоединяет молекулы-доноры (на этом, в частности, основано его применение в органическом синтезе)
:
-
![{\displaystyle {\mathsf {AlBr_{3}+C_{2}H_{5}Br}}\rightarrow {\mathsf {[C_{2}H_{5}]^{+}[AlBr_{4}]^{-}}}}](/images/005/352/5352071/20.jpg?rand=729415)
Получение
Безводный бромид алюминия получают взаимодействием
простых веществ
(
Al
и
Br
2
)
:

Водный раствор можно получить реакцией алюминиевой стружки с
бромоводородной кислотой
:

Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав
ксилольных
электролитов
для электроосаждения алюминиевых покрытий
.
Безводный бромид алюминия используется в органическом синтезе, в частности, в
реакции алкилирования по Фриделю-Крафтсу
, по аналогии с
хлоридом алюминия
.
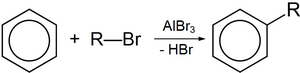
Соединение может выступать катализатором в реакции
изомеризации
бромалканов, например
:

Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с
хлороформом
:

Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Примечания
-
↑
Лидин Р.А., Андреева Л.Л., Молочко В.А.
Глава 3. Физические свойства
// Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. —
М.
: «Дрофа», 2006. — С. 74. —
ISBN 5-7107-8085-5
.
-
↑
Турова Н.Я.
Неорганическая химия в таблицах. —
М.
: Высший химический колледж РАН, 1997. — С. 67.
-
Лидин Р.А., Андреева Л.Л., Молочко В.А.
Часть IV. Термодинамика. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ
// Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. —
М.
: «Дрофа», 2006. — С. 441. —
ISBN 5-7107-8085-5
.
-
↑
(англ.)
: A CRC quick reference handbook
—
CRC Press
, 1993. —
ISBN 978-0-8493-4498-5
-
Chambers C., Holliday A.K.
. — Chichester: Butterworth & Co (Publishers) Ltd, 1975. — P.
.
-
Дроздов А.А., Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М.
Неорганическая химия. Т.2: Химия непереходных элементов / Под ред. акад. Ю.Н.Третьякова. —
М.
: Издательский центр «Академия», 2004. — Т. 2. — С. 86. —
ISBN 5-7695-1436-1
.
-
Лидин Р.А., Андреева Л.Л., Молочко В.А.
Глава 6. Энергия связи для многоатомных частиц
// Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. —
М.
: «Дрофа», 2006. — С. 384. —
ISBN 5-7107-8085-5
.
-
↑
Ахметов Н.С.
Общая и неорганическая химия. Учебник для вузов. — 4-е изд., исправленное. —
М.
: «Высшая школа», 2001. — С. 498. —
ISBN 5-06-003363-5
.
-
Алюминий
// Химическая энциклопедия / Главный редактор И. Л. Кнунянц. —
М.
: «Советская энциклопедия», 1988. — Т. 1. — С. 207.
-
Лидин Р.А., Андреева Л.Л., Молочко В.А.
Часть VII. Плотность воды и водных растворов. Глава 3. Соли
// Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. —
М.
: «Дрофа», 2006. — С. 641. —
ISBN 5-7107-8085-5
.
-
Гофман У., Рюдорф В., Хаас А. и др.
Руководство по неорганическому синтезу. — Пер. с нем., под ред. Г.Брауэра. —
М.
: «Мир», 1985. — Т. 3. — С. 899.
-
от 4 марта 2016 на
Wayback Machine
— видеоопыт в Единой коллекции цифровых образовательных ресурсов
-
Спиридонов Б.А., Федянин В.И.
(неопр.)
Российское общество гальванотехников и специалистов в области обработки поверхности. Дата обращения: 26 октября 2009.
18 мая 2008 года.
-
Douwes H.S.A.
The kinetics of the aluminium bromide catalyzed isomerization of 1-propyl bromide
(англ.)
// Journal of Molecular Catalysis A: Chemical. — 2005. —
Vol. 240
,
no. 1-2
. —
P. 82-90
.
-
(англ.)
(pdf). FreePatentsOnline (май 1951). Дата обращения: 26 октября 2009.
9 апреля 2012 года.
Литература
-
Ахметов Н. С.
Общая и неорганическая химия. —
М.
: Высшая школа, 2001. —
ISBN 5-06-003363-5
.
-
Лидин Р. А..
Справочник по общей и неорганической химии. —
М.
: КолосС, 2008. —
ISBN 978-5-9532-0465-1
.
-
Некрасов Б. В.
Основы общей химии. —
М.
: Лань, 2004. —
ISBN 5-8114-0501-4
.
-
Спицын В. И.
, Мартыненко Л. И.
Неорганическая химия. —
М.
: МГУ, 1991, 1994.
-
Турова Н. Я.
Неорганическая химия в таблицах. Учебное пособие. —
М.
: ЧеРо, 2002. —
ISBN 5-88711-168-2
.
-
Downs A.J.
Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — 526 p. —
ISBN 0-7514-0103-X
.

|
|
Интерметаллиды
|
|
|
Оксиды, гидроксиды
|
|
|
Соли
|
|
|
Алюминаты
|
|
|
Галогениды
|
|
Металлоорганические
соединения
|
|
Соединения
с неметаллами
|
|
|
Гидриды
|
|
|
Другие
|
|